Симптомы и лечение золотистого стафилококка у взрослых и детей
Золотистый стафилококк – признаки и лечение. Симптомы золотистого стафилококка в кишечнике у взрослых
Золотистый стафилококк – аэробная бактерия, отличающаяся шарообразной формой и неподвижностью. Может провоцировать развитие разных заболеваний у детей. У взрослых встречается крайне редко. Анализ на золотистый стафилококк поможет выявить его присутствие в окружающей среде – на игрушках и посуде, постельном белье и коже человека, как абсолютно здорового, так и больного.
Классификация инфекции
В медицине выделяют две формы стафилококковой инфекции – генерализованную и очаговую. В первом случае речь идет о сепсисе, когда все системы и органы заражены стафилококком. Сепсис – опасное состояние, которое часто заканчивается летальным исходом даже на фоне оказания квалифицированной медицинской помощи.
Чаще диагностируется очаговая форма стафилококковой инфекции, когда выявляются заболевания кожных покровов, костной ткани, суставов.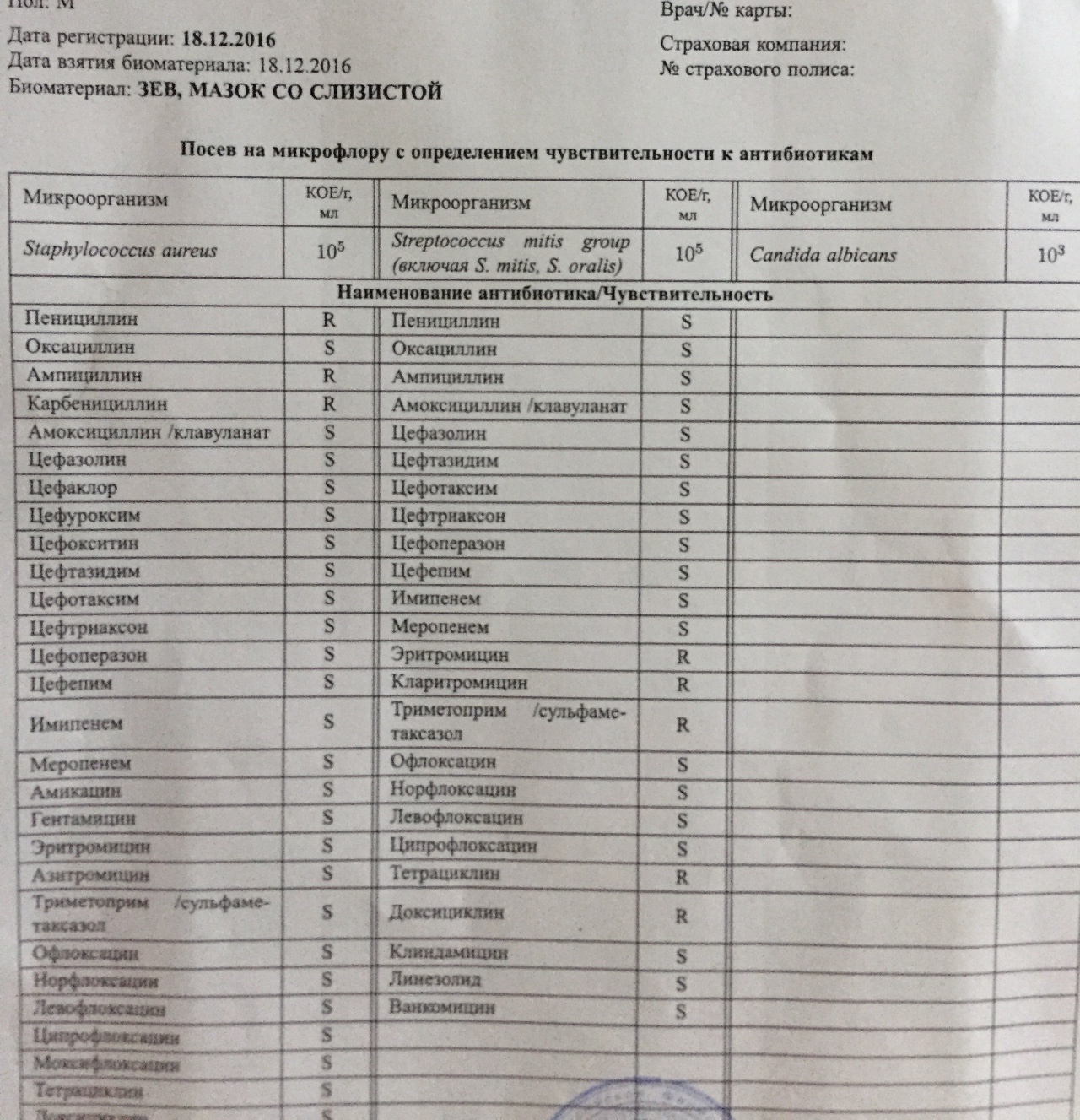 Отдельно врачи выделяют пищевое отравление токсинами – с характерными симптомами золотистого стафилококка в кишечнике у взрослых.
Отдельно врачи выделяют пищевое отравление токсинами – с характерными симптомами золотистого стафилококка в кишечнике у взрослых.
Стафилококковая инфекция может протекать в легкой, средней и тяжелой степени, острой или хронической форме.
Симптомы стафилококковой инфекции
Аэробную бактерию можно найти на поверхности кожи даже у здорового человека, поэтому удивляться ее наличию не стоит. Инфекция разовьется только в том случае, если «сработают» провоцирующие факторы – сниженный иммунитет, вирусное заболевание, хирургическое вмешательство, травмы, половая инфекция и так далее. Принято считать, что после лабораторного исследования посевов биоматериала, взятого из разных мест организма, можно выявить истинную угрозу наличия стафилококка. Врачи различают несколько степеней присутствия колоний аэробной бактерии. Если колоний обнаружено в пределах 10, а степень равна 6, то это высшая граница нормы. Более высокие показатели будут свидетельствовать о выраженной патологии. Получив результат анализа «золотистый стафилококк на коже 10 в степени 5», беспокоиться не нужно – лечение будет непродолжительным и обязательно с положительным результатом.
Заболевания, вызванные рассматриваемой аэробной бактерией, не имеют каких-либо отличительных признаков. Если золотистый стафилококк поражает горло, то у человека может развиться ангина, фарингиты и ларингиты, отличающиеся тяжелым течением с высокой температурой тела и сильной слабостью. Заболевания дыхательной группы с частыми рецидивами считаются основным признаком присутствия бактерии в зеве.
Кроме этого, золотистый стафилококк может быть выявлен:
- в костной ткани – инфекция проникает при переломах или тяжелых ранениях;
- в фурункулах, карбункулах и абсцессах – как правило, инфицируется волосяная луковица, и процесс воспаления запускается снова и снова даже на фоне проводимого лечения;
- на коже – у ребенка появляются высыпания, дерматиты.
Нередко выявляется золотистый стафилококк у грудничка в кале. Диагностироваться это может еще в роддоме – инфицирование происходит во время тяжелых родов на фоне сниженного иммунитета у недоношенных детей или младенцев с врожденными патологиями.
Самое тяжелое состояние при инфицировании аэробной бактерией – токсический шок. Он отличается характерными симптомами – резким повышением температуры до критических показателей, тошнотой, острой болью в голове, сыпью на теле, появлением гнойного отделяемого из имеющихся ран. В таком случае никакие исследования не проводятся – только золотистый стафилококк может вызвать данное состояние. Назначается срочная терапия.
Лечение золотистого стафилококка
Антибиотики против золотистого стафилококка не всегда эффективны, поэтому их назначают лишь на начальной стадии развития заболевания. Эффективными будут только антибиотики последнего поколения – цефалоспорины и другие непенициллинового ряда.
Чаще всего врачи применяют комбинированную терапию. Если требуется лечение золотистого стафилококка в горле у ребенка, то будут назначены:
- обработка слизистой антисептическими растворами – хлорфиллиптом;
- иммуностимулирующие препараты;
- антистафилококковый бактериофаг.

Многих интересует, как вылечить золотистый стафилококк в зеве, который вызывает частые ангины, ларингиты, тонзиллиты. Без назначений врача не обойтись – привычные лекарственные препараты не помогают либо дают кратковременный эффект выздоровления. Специалист даст рекомендации по обработке слизистой глотки антисептическими растворами, проведет исследование на восприимчивость бактерии к антибиотикам и сделает медикаментозные назначения.
Чаще всего колонии рассматриваемых бактерий обнаруживаются в носу – они могут годами там находиться и не вызывать никаких заболеваний. Если же ребенок часто простужается, имеет отставание в росте и развитии, то хронических патологий не избежать. Как лечить золотистый стафилококк в носу у детей:
- госпитализировать ребенка в лечебное учреждение;
- проводить ежедневную санацию слизистой носа и глотки, так как имеется большой риск распространения инфекции;
- выполнять назначения врача для снятия тяжелых симптомов.

Независимо от того, какой именно орган поражен стафилококком, обязательно будут назначаться витамины, иммуномодуляторы и пробиотики для восстановления кишечной микрофлоры.
Длительность лечения стафилококковой инфекции – от 7 до 30 дней, что зависит от своевременности диагностирования заболевания и выявления больших колоний бактерии. Если терапия проводится в точном соблюдении назначений лечащего врача, то прогноз по заболеванию благоприятный.
Более подробно о том, как передается золотистый стафилококк и какие симптомы укажут на наличие аэробных бактерий, можно узнать на нашем сайте Добробут.ком.
Стафилококк не виноват? Причины и лечение фарингита | Здоровая жизнь | Здоровье
Рассказывает наш эксперт – врач-отоларинголог Иван Лесков.
Иногда банальный фарингит тянется годами: то исчезает, то возвращается. А пациент вынужден принимать антибиотики, периодически курсируя между кабинетом лечащего врача и лабораторией. Увы, мазок на флору миндалин чаще всего упорно показывает наличие золотистого стафилококка. С ним обычно и борются, упуская, что фарингитмогут вызвать и другие микроорганизмы.
Увы, мазок на флору миндалин чаще всего упорно показывает наличие золотистого стафилококка. С ним обычно и борются, упуская, что фарингитмогут вызвать и другие микроорганизмы.
Исследования некорректны?
Медики придерживаются принципа доказательной медицины: осмотр – лабораторные исследования – назначенное по его результатам лечение. И если анализы показали наличие золотистого стафилококка, назначают антибиотики. Но спустя короткое время боль в горле возвращается. И так – по кругу.
Именно исследования – то самое «слабое звено», которое подводит и врачей, и пациентов. Да, анализы постоянно показывают в горле больного стафилококк. Но причин его присутствия больше, чем хотелось бы…
Причина первая. Золотистый стафилококк – это нормальный обитатель кожных покровов. Хотим мы того или нет, в рот он попадать будет.
Причина вторая. Посевы делают на так называемую стандартную среду. Самая распространенная и дешевая – кровяной агар, плотная питательная среда для выделения определенного рода бактерий – кокков. В том числе золотистого стафилококка. Здесь он великолепно живет и «плодится», не оставляя места никаким другим микроорганизмам, которые, возможно, и стали причиной фарингита. А другие потенциальные «зачинщики» в кровяном агаре попросту не растут. Яркий пример – хламидия пневмонии.
В том числе золотистого стафилококка. Здесь он великолепно живет и «плодится», не оставляя места никаким другим микроорганизмам, которые, возможно, и стали причиной фарингита. А другие потенциальные «зачинщики» в кровяном агаре попросту не растут. Яркий пример – хламидия пневмонии.
Так что стандартные лабораторные исследования способны дать заведомо ложный результат, отправляя врача и пациента по «заколдованному кругу».
Учимся «читать» анализы
Чтобы получить точный ответ о возбудителе проблемы, ознакомьтесь с цифрами напротив латинских названий микроорганизмов. Они обозначают активно размножающиеся бактерии – так называемые колонии, образующие единицы. Все, что меньше числа 10 в пятой степени, «проходит по ведомству» случайно и недавно попавших микробов. Значит, и вездесущий стафилококк попал в горло непосредственно перед сдачей анализов. Грубо говоря, вдохнул человек воздух – и вот результат.
Второй параметр исследования – спектр чувствительности к антибиотикам. Постарайтесь вспомнить: не принимали ли вы какой-нибудь из перечисленных в анализе антибиотиков раньше, когда горло уже болело? Стафилококк – создание к антибиотикам крайне чувствительное! Значит, это явно не тот микроорганизм, который вызвал боль в горле, иначе антибиотики его давно бы «извели».
Постарайтесь вспомнить: не принимали ли вы какой-нибудь из перечисленных в анализе антибиотиков раньше, когда горло уже болело? Стафилококк – создание к антибиотикам крайне чувствительное! Значит, это явно не тот микроорганизм, который вызвал боль в горле, иначе антибиотики его давно бы «извели».
Вспомнить все!
Вспомните, в каких ситуациях вас снова и снова начинают беспокоить боли в горле. Может быть, в результате контакта с кем-то из уже заболевших? Или это следствие промокших ног, выпитой холодной воды или съеденного мороженого? Тогда действительно справедливо предположить, что в горле «сидит» какая-то инфекция, способная давать обострения. Дальше задача – искать эту инфекцию. И начинать лучше с привычного общего анализа крови. Так, ее лейкоцитарная формула может дать богатую пищу для размышлений. Даже если все показатели не выходят за пределы нормы.
Допустим, к ее верхней границе приближаются специальные лейкоциты – нейтрофилы. Это сигнал: ваш организм постоянно отражает атаки бактерий! Потому что нейтрофилы и есть «бойцы» с инфекцией.
Другая ситуация: нейтрофилы – на нижней границе нормы. Зато на верхней находится другая разновидность лейкоцитов – лимфоциты. Значит, ваш организм все равно постоянно отражает атаки. Только противник другой, но не менее опасный: хламидии, микоплазма, вирус.
Проанализировав простой анализ крови, можно убрать бо´ льшую половину возможных возбудителей. При этом экономя время и деньги на другие исследования.
Куда обратиться?
Если пациент действительно столкнулся с бактериальной инфекцией, за помощью ему надо идти не к отоларингологу, а, как минимум, к опытному терапевту или инфекционисту: «Доктор! У меня постоянные бактериальные инфекции. В мазке – стафилококк, но я знаю, что это не он». Врач будет искать другие инфекции. Например, стрептококк, прекрасно чувствующий себя на слизистых, моракселлу…
Если проблема кроется в вирусе, лучше идти к иммунологу. Он занимается хроническими вирусными инфекциями. И уж точно повод для обращения к иммунологу – когда высеянные микроорганизмы нечувствительны к большинству протестированных антибиотиков (этот факт сотрудники лаборатории отражают латинской буквой «R» – резистентность, устойчивость).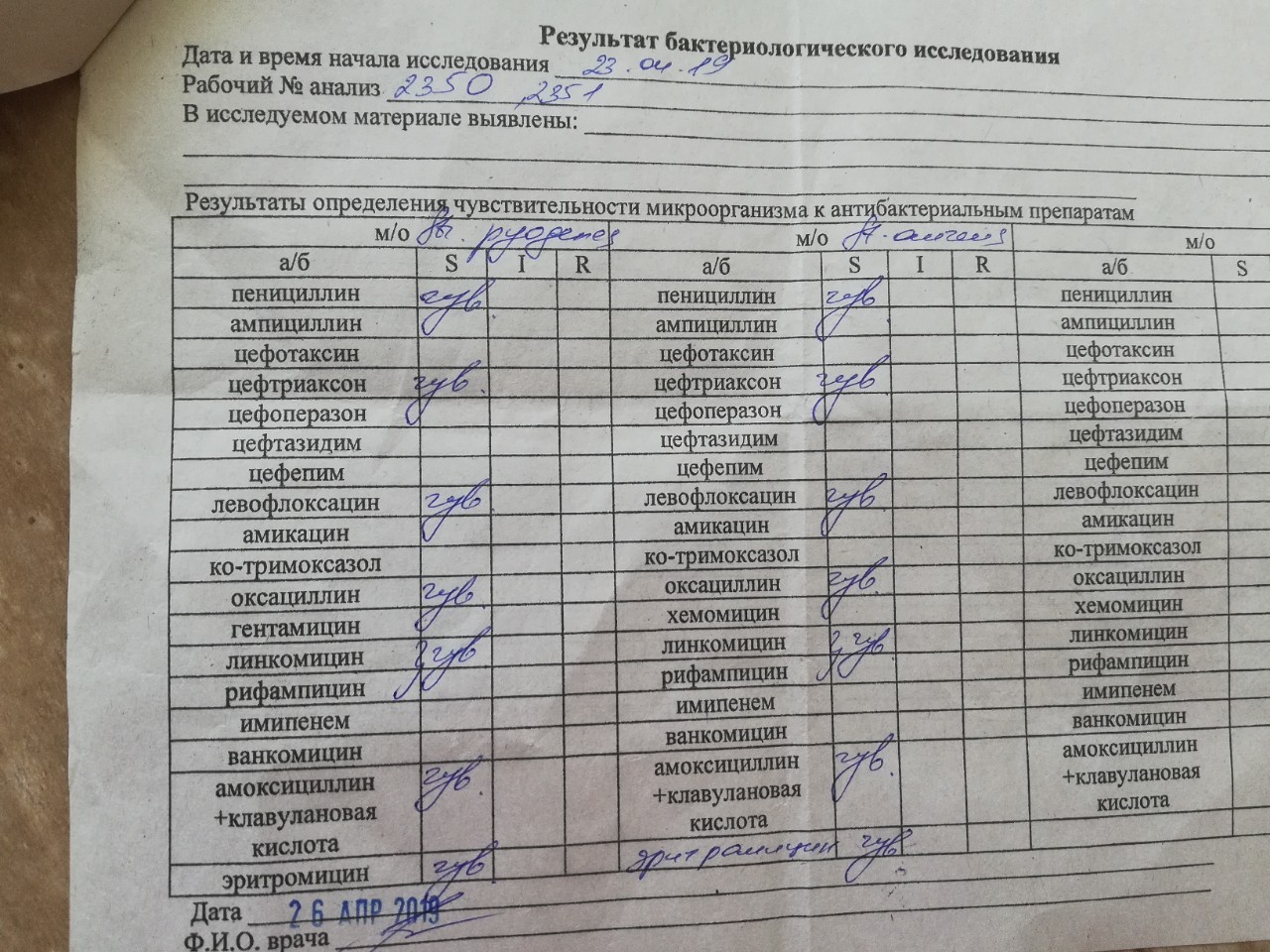
Грамотные врачи не будут предлагать вам эксперименты со все новыми и новыми антибиотиками или, как вариант, с препаратами бактериофагов, а постараются предельно мягко для организма устранить сбой в иммунной системе.
Читайте в соцсетях!
Золотистый стафилококк 10 в 8 в зеве у ребенка — Педиатрия — 20.04.2013
анонимно (Женщина, 27 лет)
Стафилококк золотистый и кандиды в зеве у ребенкаРебенку годик.Никак не можем избавится от кандиды в зеве 10/7,месяц назад было 10/6. Все пошло после антибиотиков зиннат,во рту молочница была. Так же в кишечнике кандиды были выше нормы,пили линекс,от…
Наталья Безрукова (Женщина, 31 год)
Кандидоз золотистый стафилококк синегнойной в зеве ребенкаЗдравствуйте, у ребенка с 1.5 обнаружили в зеве кандиду,прошли лечение. Сейчас сдали посев на микрофлору candida glatrata 102KOE,saureus
анонимно (Мужчина, 3 года)
Как вылечить золотистый стафилококк в зеве у ребенкаДобрый день, у ребенка 2,7 года увеличены миндалины и белесоватый налет. Сдали посев из зева обнаружен золотистый стафилококк 1х10*4, чувствительность к препаратам бактериофаг стафилококковый, оксациллин 1 мкг, ципрофлоксацин, ванкомицин, гентамицин,…
Сдали посев из зева обнаружен золотистый стафилококк 1х10*4, чувствительность к препаратам бактериофаг стафилококковый, оксациллин 1 мкг, ципрофлоксацин, ванкомицин, гентамицин,…
анонимно (Женщина, 30 лет)
Золотистый стафилококк в горлеУ ребенка 3,8 постоянно в мазке из горла высевается золотистый стафилококк 4плюса. Лечение полосканиями и бактериофагами не помогает, антибиотики тоже. Ребенок постоянно болеет,боллее 2недель в сад не ходит. Начинается все…
анонимно (Женщина, 25 лет)
Золотистый стафилококк в молоке матери и кишечнике ребенкаДобрый день, андрей сергеевич! Подскажите, пожалуйста, в нашем городе нет ни инфекциониста ни иммунолога. Сдавали кал на дисбактериоз, когда ребенку был месяц, обнаружили золотистый стафилококк и еще другие бактерии. Из-за…
анонимно
Золотистый стафилококк в кишечникеДобрый день! Моему ребенку 5,5 месяцев, с самого рождения мучаемся с животиком, проблемы со стулом, постоянно покраснения вокруг ануса, особенно после частого жидкого стула, что только не давали, пили лактобактерин,. ..
..
анонимно
Золотистый стафилококк 10 в 8 в зеве ребенкаЗдравствуйте. У дочери, 5 лет, обнаружен стафилококк 10 в 8 в горле. За 3 месяца до этого мы прошли лечение по поводу хронического тонзиллит и аденойдов.(миндалины наследственные рыхлые и гипертрофированные)…
Стафилококковая инфекция
«Стафилококк» — это сокращенное название распространенной бактерии, которая называется «золотистый стафилококк». Бактерии стафилококка часто присутствуют на коже, не вызывая инфекции. Инфекция развивается, если они проникают под кожу. Это вызывает покраснение, болезненную чувствительность, отекание и иногда жидкие выделения.
МРЗС означает «метициллин-резистентный золотистый стафилококк» («Methicillin-Resistant Staph Aureus») В отличие от обычной стафилококковой инфекции, бактерии МРЗС устойчивы к воздействию обычных антибиотиков (antibiotics) и сложнее поддаются лечению. Кроме того, бактерии МРЗС более токсичны, чем обычные бактерии стафилококка. Они могут быстро распространяться в организме и вызывать опасное для жизни заболевание.
МРЗС передается при непосредственном физическом контакте с бактериями. МРЗС также передается через предметы, зараженные человеком, являющимся носителем бактерий, такие как повязки, полотенца, постельное белье или спортивный инвентарь. Обычно бактерии не передаются через воздух. Однако они могут передаваться при непосредственном контакте с жидкостью, выделяемой при кашле или чихании. Если у вас кожная инфекция МРЗС, существует риск рецидива в будущем.
При подозрении на инфекцию МРЗС врач может сделать посев выделений из раны (wound culture) для подтверждения диагноза. При наличии абсцесса он может быть дренирован. Вероятно, вам будет назначен один или несколько антибиотиков, которые действуют на МРЗС.
Уход в домашних условиях
Принимайте антибиотики в точном соответствии с назначением. Даже если вы почувствовали себя лучше, не прекращайте принимать их, пока они не закончатся, или до тех пор, пока не получите указание прекратить их прием от своего лечащего врача.

Если вам была назначена мазь с антибиотиком, применяйте ее в соответствии с полученными указаниями.
В течение 5 дней ежедневно мойте все тело (от волосистой части головы до пальцев ног) специальным мылом. Два раза в день чистите ногти пальцев рук в течение 1 минуты щеткой со специальным мылом.
Раны должны быть закрыты чистыми и сухими повязками. Если повязки загрязнились, их необходимо заменить. Каждый раз, когда вы меняете повязку или касаетесь раны, тщательно мойте руки.
Если у вас наращенные ногти или лак на ногтях, их необходимо снять.
Лечение членов семьи
Если у вас диагностировано возможное заражение инфекцией МЗРМ, ваши близкие, живущие вместе с вами, подвержены более высокому риску наличия бактерий на коже или в носу, даже при отсутствии признаков инфекции. Бактерии необходимо удалить с кожи всех членов семьи одновременно, чтобы они не передавались от одного к другому. Проинструктируйте их, как следует удалить бактерии:
Члены семьи должны использовать специальное мыло, как описано выше.

Если у кого-либо из членов семьи имеется кожная инфекция, ее должен лечить врач. Чтобы вылечить инфекцию МРЗС, мытья не достаточно.
Очистите столешницы и детские игрушки.
Каждый член семьи должен пользоваться только своими предметами личного обихода, такими как зубные щетки или бритвенные станки. При этом пользоваться общими очками, тарелками и столовыми приборами разрешается.
Предотвращение распространения инфекции.
Часто мойте руки простым мылом и теплой водой. Обязательно очищайте зоны под ногтями, между пальцами и запястья. Вытирайте руки одноразовыми полотенцами (например, бумажными). Если нет возможности воспользоваться мылом и водой, можно использовать антисептик для рук на основе спирта. Втирайте антисептик по всей поверхности рук, пальцев и запястий до полного высыхания.
Не пользуйтесь чужими предметами личного обихода, такими как полотенца, бритвенные станки, одежда или униформа. Стирайте постельное белье, полотенца и одежду в горячей воде со стиральным порошком.
 Устанавливайте для сушилки режим высокой температуры, чтобы убить оставшиеся бактерии.
Устанавливайте для сушилки режим высокой температуры, чтобы убить оставшиеся бактерии.Если вы посещаете тренажерный зал, до и после каждого применения протирайте инвентарь антисептиком на основе спирта. Также протирайте все ручки и места, за которые беретесь руками.
Если вы занимаетесь спортом, после каждой тренировки принимайте душ с обычным мылом. Каждый раз после душа используйте чистое полотенце.
Последующее наблюдение
Приходите на контрольные приемы, назначенные вашим врачом, или в соответствии с указаниями, полученными от наших сотрудников. Если был сделан посев выделений из раны, получите результаты в указанное время. Если в ваш курс лечения будут внесены какие-либо изменения, вам о них сообщат.
Если у вас был диагностирован МРЗС, в будущем вам необходимо будет сообщать медицинскому персоналу о том, что вы проходили лечение от этой инфекции.
Когда необходимо обратиться за медицинской помощью
В любом из следующих случаев обратитесь в обслуживающее вас медицинское учреждение:
Усиливающееся покраснение, опухание или боль
Красные полосы в коже вокруг раны
Слабость или головокружение
Появление гноя или выделений из раны
Температура выше 100,4 ºF (38,0 ºС) или в соответствии с указаниями вашего лечащего врача
Стафилококк в носу — признаки, причины, симптомы, лечение и профилактика
Диагностика
Основным методом диагностики стафилококка в носу является проведение лабораторной диагностики путем выделения бактерий в чистом виде в результате проведения посева на питательные среды.
Также при выполнении посева очень важным этапом является определение чувствительности стафилококка к отдельным антибиотикам.
Дополнительно должен быть произведен осмотр полости носа врачом, при необходимости – рентгенография носовых пазух в случае появления симптомов осложнений заболевания.
Лечение
После установления диагноза при выявлении стафилококка в носу, отоларингологи используют следующие методы лечения:
- назначение антибиотиков с учетом результатов проведенного лабораторного исследования на устойчивость стафилококка к некоторым препаратам;
- применение антистафилококкового бактериофага;
- санация очагов инфекции при наличии гнойников;
- проведение иммунотерапии: введение антистафилококкового иммуноглобулина или анатоксина;
- промывание носовых ходов раствором хлорофиллипта.
Профилактика
С целью предупреждения поражения стафилококковой инфекцией полости носа рекомендуется:
- тщательно соблюдать правила личной гигиены;
- укреплять иммунитет путем закаливания, дозированной физической нагрузки, рационального питания;
- использовать средства для лечения насморка и других заболеваний лор-органов только по назначению врача.

Литература и источники
Видео по теме:
симптомы и лечение золотистого у детей, чем лечить ауреус
Золотистый стафилококк в носу или горле сегодня диагностируют у многих людей. Стафилококковая инфекция – это воспалительный процесс, который формируется в результате поражения организма золотистым стафилококком. Его активизация может произойти по причине приема антибиотиков. Чаще всего подвергаются недугу дети, старики и люди со слабым иммунитетом.
Симптомы
Распознать патологический процесс можно по следующей симптоматике:
- Боль, жжение, першение и ссадение в горле.
 Человек испытывает необходимость в постоянном сглатывании. Отмечается легкое покашливание, жжение в горле. Локальная симптоматика заболевания нарастает на протяжении нескольких часов, а может затянуться до нескольких дней. Затем инфекционный процесс перетекает в более выраженную форму.
Человек испытывает необходимость в постоянном сглатывании. Отмечается легкое покашливание, жжение в горле. Локальная симптоматика заболевания нарастает на протяжении нескольких часов, а может затянуться до нескольких дней. Затем инфекционный процесс перетекает в более выраженную форму. - Нагноение. Патогенные микроорганизмы, поражая слизистую, синтезируют особые ферменты. Они наносят разрушающее действие клеткам организма. Питание у этих микробов осуществляется продуктами разрушения клеток. Помимо этого, это еще и возможность для них продвинуться вглубь тканей. Клетки иммунитета пытаются дезактивировать бактерии, в результате чего формируется гной. При поражении золотистым стафилококком горла у человека возникают гнойнички и воспаляются миндалины.
- Подъем температуры. Так как любая инфекция предполагает наличие гнойного процесса, то показатели температуры при этом повышаются.
- Общая интоксикация. При поражении золотистым стафилококком горла у человека отмечается слабость, тошнота, плохой аппетит и головокружение.

- Кашель. Этот симптом при стафилококке в горле является главным признаком инфекции.
Чем опасен
Наличие золотистого стафилококка в горле несет в себе потенциальную угрозу для здоровья человека. При нормальном иммунитете рост и развитие бактерий сдерживают собственные силы организма. Но когда защитные силы понижаются, то создаются благоприятные условия для развития инфекционных процессов.
Сосредотачиваясь в горле, заболевание может поражать остальные органы дыхания, если не осуществить адекватную терапию. При этом происходит обострение таких хронических болезней, как артрит, сахарный диабет.
При запущенном инфекционном процессе золотистый стафилококк в горле может нанести поражение лимфатическим путям и привести к развитию септицемии.
Подобное состояние грозит серьезными проблемами со здоровьем, что может закончиться летальным исходом. Но только представленные проблему со здоровьем могут возникнуть, если не осуществить адекватное лечение.
А вот можно ли греть горло при ангине и как это делать правильно, поможет понять данная статья.
Чем можно полоскать горло при гнойной ангине и как правильно подобрать лекарство, рассказывается в данной статье.
А вот как выглядит белый налет на задней стенке горла, можно увидеть здесь в статье: https://prolor.ru/g/simptomy-g/belyj-nalet-v-gorle-u-vzroslogo.html
Почему возникает острая боль в горле без температуры и какие лекарственные средства самые эффективные, подробно рассказывается в данной статье.
Лечение у взрослых
Терапевтические мероприятия у взрослого человека должны быть направлены на устранение золотистого стафилококка и облегчение симптоматики.
Иммуностимуляция
Первым делом необходимо повысить иммунитет человека, чтобы он смог дать отпор влиянию бактерий. Золотистый стафилококк в горле– это опасная бактерия. При ее повышенной концентрации в организме иммунитет будет угнетен.
Помочь здесь смогут иммуномодуляторы. Эти лекарства содержат деактивированные фрагменты разных бактерий. Благодаря им удается запустить синтез собственного интерферона и прочие процессы, которые в сочетании с друг другом смогут улучшить сопротивление, оказываемое иммунной системой.
Эти лекарства содержат деактивированные фрагменты разных бактерий. Благодаря им удается запустить синтез собственного интерферона и прочие процессы, которые в сочетании с друг другом смогут улучшить сопротивление, оказываемое иммунной системой.
На видео- золотистый стафилококк в горле:
Иммуномодуляторы бывают двух видов: общего и местного влияния. Для лечения золотистого стафилококка задействуют лекарства местного действия. Самыми эффективными считаются:
- Имудон. Этот препарат в виде пастилок для рассасывания. Прием вести по 8 таблеток в сутки.
 Общая продолжительность составит 7-10 дней.
Общая продолжительность составит 7-10 дней.Имудон
- ИРС-19. Этот спрей позволяет обрабатывать носовые ходы или слизистую горла. Применять по 1-2 распыления 5 раз в сутки. Общая продолжительность приема составит 7 дней.
Антибиотики
Если была диагностирована развёрнутая стафилококковая инфекция, то лечение обязательно должно включать антибактериальные препараты. золотистые стафилококки могут иметь иммунитет на некоторые антибиотики.
Но есть ряд препаратов, к которым бактерия чувствительная:
- Азитромицин; (а вот как использовать Азитромицин при ангине у взрослых, поможет понять данная статья)
Азитромицин в капсулах
- Ципрофлоксацин;
Ципрофлоксацин в таблетках
- Цефриаксон;
Цефриаксон для инъекций
- Линезолид;
- Тейкопланин;
- Ванкомицин;
- фузидиевая кислота.
Есть антибиотики, представленные в виде спрея: Мирамистин при ангине у взрослых и детей (а вот можно ли промывать нос Мирамистином ребенку, поможет понять данная информация) и спрей для горла Биопарокс. Также можно закапывать Мирамистин в нос при беременности. Но и злоупотреблять антибактериальными препаратами не стоит. Дело в том, что они оказывают агрессивный эффект на слизистую рта и горла.
Также можно закапывать Мирамистин в нос при беременности. Но и злоупотреблять антибактериальными препаратами не стоит. Дело в том, что они оказывают агрессивный эффект на слизистую рта и горла.
Полоскание горла
Можно применять антисептические растворы на травах:
Нужно взять 20 капель настойки календулы или Хлорофиллипт. Добавить в 100 мл воды. Можно Хлорофиллиптом полоскать горло 3 раза в сутки.
Народные средства
Есть несколько эффективных рецептов при лечении золотистого стафилококка в горле:
- Взять такие травы, как подорожник, шалфей, душица. На 20 г сырья 200 мл кипятка. Установить на огонь и дождаться, пока закипит. Затем томить 10 минут. Отфильтровать, остудить и добавить мед. Принимать в качестве обычного чая несколько раз в день. Приготовленное лекарство оказывает мощное противомикробное влияние.
Подорожник для полоскания горла
- Справиться с инфекцией и повысить защитные силы организма можно при помощи настоя шиповника.
 Его принимать 100 г 2 раза в сутки. Взять 20 г и залить 200 мл кипятка. Перед употреблением настой необходимо отфильтровать.
Его принимать 100 г 2 раза в сутки. Взять 20 г и залить 200 мл кипятка. Перед употреблением настой необходимо отфильтровать. - Каждый день употреблять по 100 г черной смородине. В составе этой ягоды имеются компоненты, которые оказывают пагубное влияние на бактерии. Также состав черной смородины содержит много витаминов и микроэлементов для поддержания иммунитета. Аналогичным эффектом обладает абрикос. Его нужно употреблять по 500 г в день.
Лечение у детей
Терапия по устранению золотистого стафилококка в горле у детей включает в себя проведение санации. Для этих целей задействуют:
- Антисептические растворы местного действия. Сюда стоит отнести Лизобакт – 1 пастилка 3 раза в день (что лучше Фарингосепт или Лизобакт ребенку, поможет понять данная статья), Октенисепт – по 1-2 распыления 2 раза в день. Последний препарат могут применять для получения лечебного раствора для полоскания. Соединить его с водой в соотношении 1:2.
 Читайте инструкцию к Октенисепту.
Читайте инструкцию к Октенисепту.Октенисепт
- Стафилококковый бактериофаг. Его задействуют для полоскания горла 3 раза в день.
А вот иммуномодулирующие препараты при лечении инфекции детям не назначают.
Лечение при беременности
Во время вынашивания ребенка женщине не рекомендовано принимать лекарственные препараты. Причем это относится как к антибиотикам, так и иммуномодуляторам. Для лечения можно задействовать такие мероприятия:
- Антисептические растворы распылять в горло. Для этих целей стоит применять препараты на основе Мирамистина.
Мирамистин
- Стафилококковый бактериофаг применять для полоскания горла.
- Рассасывать пастилки Лизобакт.
Если придерживаться всех рекомендаций своего врача, то золотистый стафилококк не несет в себе высокой опасности. Главное, это вовремя посетить врача и не заниматься самолечением. Также пересмотрите питание и включите в свой план прогулки на свежем воздухе.
«Страшный зверь» стафилококк / «Мой кроха и я»
Сентябрь 2010Наталия Рубина; консультанты: Ирина Перрэн, заведующая педиатрическим отделением Европейского Медицинского Центра; Наталья Таран, неонатолог, к. м. н., научный I сотрудник научно-консультативного отделения 1 НИИ Питания РАМН
Сразу после рождения малыш сталкивается с очень опасным врагом — золотистым стафилококком. Как распознать стафилококковую инфекцию и, по возможности, избежать её?
История одной мамы
На 12-й день после выписки из роддома Олеся обнаружила, что у её маленькой дочки опухли и стали гноиться глазки, а на попке появились покраснения. При этом малышка не переставая плакала. Участковый врач осмотрела девочку и предположила, что покраснения на её коже — результат погрешностей в питании мамы. Олеся села на жесточайшую диету. Однако ещё через две недели вокруг рта у ребёнка появились какие-то высыпания, кожа начала отчаянно шелушиться, а у самой Олеси появились трещины на сосках, грудь стала твёрдой и очень болезненной, подскочила температура.
В детской поликлинике ей предложили сдать грудное молоко на анализ. Через пару дней стали известны его результаты — в молоке обнаружен эпидермальный и золотистый стафилококк. Участковый врач настаивала на прекращении грудного вскармливания и назначила смесь. В течение месяца Олеся и её дочь принимали антибиотики. При этом она продолжала сцеживать молоко, не давая его ребёнку. За этот месяц малышке стало заметно лучше, и отпала необходимость давать ей лекарства. Второй анализ молока показал наличие в нём только эпидермального стафилококка, но врач всё равно настаивала на отмене грудного вскармливания. Тогда Олеся решила обратиться за консультацией к другому доктору, и тот заверил её, что наличие в молоке любой разновидности стафилококка не опасно для ребёнка. Когда Олесиной дочке исполнилось 2 месяца, она уже снова питалась исключительно маминым молоком.
Прокомментировать эту ситуацию мы попросили неонатолога Наталью Таран: «Скорее всего, девочка заразилась стафилококковой инфекцией ещё в роддоме, и после выписки болезнь перешла в активную форму. А уже от ребёнка через трещины на сосках заразилась и мама. Те высыпания на коже, которые участковый врач приняла за результат неправильного питания мамы, скорее всего, были также вызваны стафилококковой инфекцией. При этом странно, что врач не уделила никакого внимания симптомам конъюнктивита. Ведь он тоже может быть вызван стафилококком. Гнойное отделяемое из глаз нужно было сдать на анализ, чтобы выявить возбудителя. Зато врач явно переусердствовала, отменив грудное вскармливание. Если мама получает антибиотики против стафилококковой инфекции, то с молоком лечение против болезни получает и ребёнок. Грудное вскармливание отменяется в единственном случае — если у мамы гнойный мастит. Но молоко с гнойным отделяемым ребёнок не станет пить и сам. Хорошо, что мама не растерялась и, почувствовав сомнение, обратилась за дополнительной консультацией к другому специалисту».
А уже от ребёнка через трещины на сосках заразилась и мама. Те высыпания на коже, которые участковый врач приняла за результат неправильного питания мамы, скорее всего, были также вызваны стафилококковой инфекцией. При этом странно, что врач не уделила никакого внимания симптомам конъюнктивита. Ведь он тоже может быть вызван стафилококком. Гнойное отделяемое из глаз нужно было сдать на анализ, чтобы выявить возбудителя. Зато врач явно переусердствовала, отменив грудное вскармливание. Если мама получает антибиотики против стафилококковой инфекции, то с молоком лечение против болезни получает и ребёнок. Грудное вскармливание отменяется в единственном случае — если у мамы гнойный мастит. Но молоко с гнойным отделяемым ребёнок не станет пить и сам. Хорошо, что мама не растерялась и, почувствовав сомнение, обратилась за дополнительной консультацией к другому специалисту».
Стафилококки — это целый род бактерий. На сегодня известно множество видов стафилококка, многие из которых живут на коже и слизистых оболочках человека, а также в кишечнике. Большинство стафилококков абсолютно безвредны, вызывать болезни могут только три представителя этого семейства — эпидермальный, сапрофитный и золотистый стафилококки. Причём последний — самый опасный. Организм здорового человека с лёгкостью справляется со стафилококком. Однако если по каким-то причинам снижается иммунитет, стафилококк идёт в атаку, вызывая различные заболевания. Этот микроб также может проникнуть в организм там, где нарушена целостность кожи (у роженицы, к примеру, через трещины на сосках, а у новорождённого — через пупочную ранку).
Большинство стафилококков абсолютно безвредны, вызывать болезни могут только три представителя этого семейства — эпидермальный, сапрофитный и золотистый стафилококки. Причём последний — самый опасный. Организм здорового человека с лёгкостью справляется со стафилококком. Однако если по каким-то причинам снижается иммунитет, стафилококк идёт в атаку, вызывая различные заболевания. Этот микроб также может проникнуть в организм там, где нарушена целостность кожи (у роженицы, к примеру, через трещины на сосках, а у новорождённого — через пупочную ранку).
Знакомство со стафилококком возможно сразу же после рождения — младенец может получить эту бактерию, проходя через родовые пути или же с кожи мамы, как только она впервые приложит его к груди. Большинство детей легко справляется с микробом, но у недоношенных малышей и тех, кто родился со сниженным иммунитетом вследствие осложнений во время беременности, стафилококк может вызвать различные заболевания.
Симптомы
И у детей, и у взрослых различают раннюю и позднюю форму стафилококковой инфекции. Ранняя проявляется в течение нескольких часов после попадания бактерии в организм, болезнь при этом начинается остро и тяжело — резко повышается температура, могут начаться понос, рвота, ребёнок становится вялым, теряет аппетит. Что характерно, у младенцев с таких симптомов начинаются все инфекции. Поэтому даже не пытайтесь ставить диагноз самостоятельно, а при появлении первых признаков заболевания обращайтесь к врачу. Поздняя форма стафилококковой инфекции проявляется через 3-5 дней. Как правило, инфекция в первую очередь поражает кожу и, если вовремя не начать лечение, может пойти глубже, поражая внутренние органы, и даже вызвать сепсис.
Ранняя проявляется в течение нескольких часов после попадания бактерии в организм, болезнь при этом начинается остро и тяжело — резко повышается температура, могут начаться понос, рвота, ребёнок становится вялым, теряет аппетит. Что характерно, у младенцев с таких симптомов начинаются все инфекции. Поэтому даже не пытайтесь ставить диагноз самостоятельно, а при появлении первых признаков заболевания обращайтесь к врачу. Поздняя форма стафилококковой инфекции проявляется через 3-5 дней. Как правило, инфекция в первую очередь поражает кожу и, если вовремя не начать лечение, может пойти глубже, поражая внутренние органы, и даже вызвать сепсис.
Однако в некоторых случаях болезнь протекает и бессимптомно или с незначительными гнойничковыми поражениями кожи. Так что, если вы заметили на коже ребёнка какие-либо высыпания, не спешите списывать их на погрешности в вашем питании или потницу, — покажите их врачу. Если доктор заподозрит, что они имеют инфекционный характер, он назначит необходимые анализы, чтобы выявить возбудителя.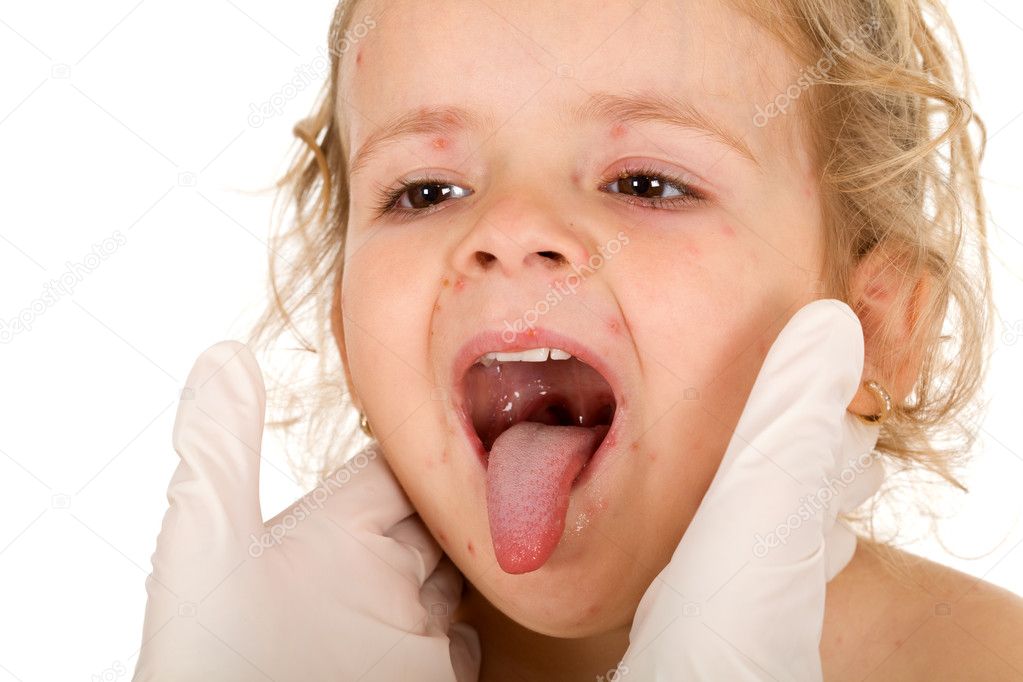 Как правило, в таких случаях делаются соскобы с кожи и общий анализ крови, который покажет, болен ли ребёнок.
Как правило, в таких случаях делаются соскобы с кожи и общий анализ крови, который покажет, болен ли ребёнок.
Бессимптомное носительство у взрослого крайне опасно для окружающих — ведь человек не знает, что он болен, и не предпринимает никаких мер, являясь при этом источником инфекции. В то же время в организме заболевшего человека количество стафилококка резко возрастает, а его патогенные свойства усиливаются. Поскольку стафилококковая инфекция передаётся контактным путём, то заразиться ей можно, просто прикоснувшись к больному.
«В организме ребёнка, иммунитет которого ослаблен в силу определённых причин, нарушается баланс полезных и вредных бактерий, и золотистый стафилококк может начать активно размножаться, — говорит педиатр Европейского Медицинского Центра Ирина Перрэн. — Но хочу особо отметить: даже если в анализах обнаружен стафилококк, но клинической картины заболевания нет (ребёнок хорошо себя чувствует, прибавляет в весе), то никакого медикаментозного лечения не требуется. Лечат пациента, а не анализы.
Лечат пациента, а не анализы.
Бить тревогу нужно, если у ребёнка есть признаки бактериальной инфекции: повышенная температура, потеря аппетита, снижение прибавки веса, появление гнойничков на коже, воспаление околопупочного кольца, понос и т. д. В таком случае следует незамедлительно обратиться к врачу, который назначит необходимое лечение».
КАК ПРОЯВЛЯЕТСЯ СТАФИЛОКОККОВАЯ ИНФЕКЦИЯ?
Стафилококковая инфекция вызывает у новорождённых множество самых различных заболеваний. Все они крайне опасны, поэтому при обнаружении первых симптомов обратитесь к врачу.
ЭНТЕРИТ (ЭНТЕРОКОЛИТ)
Признаки болезни
Частый (до 15 раз в сутки) кашицеобразный, слизистый, водянистый ступ, ребёнок плачет, часто срыгивает, его животик вздут. Может подняться высокая температура и начаться рвота. Последнее особенно опасно для младенцев, поскольку приводит к быстрому обезвоживанию организма.
Лечение
Необходима госпитализация. Как только вы заметили первые симптомы, как можно скорее вызывайте врача. А пока доктор едет, восполняйте дефицит жидкости в организме ребёнка — каждые 10 минут давайте ему столовую ложку воды.
Как только вы заметили первые симптомы, как можно скорее вызывайте врача. А пока доктор едет, восполняйте дефицит жидкости в организме ребёнка — каждые 10 минут давайте ему столовую ложку воды.
Народные средства — их можно использовать только параллельно с лечением в больнице или после выписки.
- Настой цветов календулы: 1 ч. л. цветов на стакан воды. Давать малышу понемногу в промежутках между кормлениями.
- Настой цветов ромашки аптечной: 1 ст. л. сухих цветов залить стаканом кипятка, кипятить 5 минут, настаивать 4 часа, процедить. Давать по 1 ч. л. после кормления.
ИНФЕКЦИОННЫЙ КОНЬЮНКТИВИТ
Признаки болезни
Ребёнок плачет, его глаза покраснели, опухли и слезятся, из них выделяется гной, образуются жёлто-зелёные корки. После сна ресницы склеены гноем так, что малыш с трудом открывает глазки.
После сна ресницы склеены гноем так, что малыш с трудом открывает глазки.
Лечение
Назначает врач. Необходимо сдать выделения из глаз в лабораторию на анализ, чтобы выявить возбудителя заболевания и правильно подобрать антибиотик.
Народные средства
- Протирать веки младенца грудным молоком. Однако это средство не подходит, если и у мамы в анализе молока обнаружен стафилококк.
- Протирать глаза ребёнка ватными тампонами, смоченными в чайной заварке (крепкий раствор чёрного чая).
- Прокипятите одну чайную ложку мёда в стакане воды в течение 2 минут. Когда медовая вода остынет, из неё делают примочки на глаза 2 раза в день по 20 минут. Эту же воду капают в глаза по 2-3 капли 2 раза вдень.
- Одну чайную ложку цветков календулы залить стаканом кипятка, настаивать 30-40 минут, затем тщательно процедить. Полученным раствором несколько раз в день промывать глазки ребёнка.

Признаки болезни
На коже (в нижней части живота, в складках шеи, на спине) образуется множество пузырьков с мутным содержимым. Кожа в этих местах отёчная, покрасневшая. Ребёнок вялый, отказывается от еды.
Лечение
Лекарства назначает только врач. Как правило, это курс антибиотиков.
Народные средства
- Протирать пузыри ваткой, смоченной в камфорном масле (до 4-5 раз в день).
Признаки болезни
На коже появляются багрово-красные гнойнички, которые вскрываются с выделением жёлто-зелёного гноя. У ребёнка поднимается температура, он вялый или, наоборот, капризный.
Лечение
При первых признаках заболевания обратитесь к врачу.
СЕПСИС
По течению болезни различают септицемию и септикопиемию. Септицемия начинается бурно с развития желтухи, быстрой потери массы тела, тахикардии. Ребёнок беспокойный, у него могут начаться судороги. Септикопиемия начинается с появления гнойничков на коже, иногда развиваются абсцессы. При пупочном сепсисе пупочная ранка воспаляется, кожа вокруг отёчная, красная.
Септицемия начинается бурно с развития желтухи, быстрой потери массы тела, тахикардии. Ребёнок беспокойный, у него могут начаться судороги. Септикопиемия начинается с появления гнойничков на коже, иногда развиваются абсцессы. При пупочном сепсисе пупочная ранка воспаляется, кожа вокруг отёчная, красная.
Лечение
Лечение назначает врач. Как правило, это антибиотики широкого спектра, стимулирующая терапия — переливание крови, введение плазмы, витамины.
Нона Овсепян, врач-консультант Независимой лаборатории «ИНВИТРО
Для того чтобы определить наличие стафилококка, а также других вредных бактерий в грудном молоке, необходимо сделать посев молока на микрофлору и золотистый стафилококк с определением чувствительности к антибиотикам. Для анализа грудное молоко сцеживают в стерильную пробирку или баночку (вы можете приобрести их в аптеке или лаборатории). Перед сцеживанием руки и молочные железы необходимо обработать мылом, ареолы сосков вытереть 70%-ным спиртом (каждая грудь обрабатывается отдельным тампоном).
Первая порция (5-10 мл) анализа не используется, сцеживается в отдельную посуду, а вторая (10 мл) — в стерильную посуду для анализа. Молоко из левой и правой груди смешивать нельзя, надо собирать в отдельные контейнеры. Для точного результата анализа между сцеживанием молока и доставкой его лабораторию должно пройти не более 3-х часов.
Параллельно с определением количества и качества бактерий в молоке исследуется их устойчивость к антибиотикам и бактериофагам, это необходимо для правильного подбора препарата для лечения стафилококковой инфекции.
При подозрении на стафилококковую инфекцию у новорождённого необходимо исследование кала на патогенную и условно-патогенную микрофлору. Материалом для этого анализа служит кал после естественной дефекации, который нужно собрать в одноразовый контейнер и как можно быстрее (в течение 3-х часов) доставить в лабораторию. Для того, чтобы результаты были достовернее, рекомендуется провести 2-3 кратное исследование с интервалов 1-2 дня.
Золотистый стафилококк может быть причиной развития бронхитов, пневмонии и ряда других воспалительных заболеваний дыхательной системы. В такой ситуации берётся посев с зева и носа с целью выявления золотистого стафилококка. Сдают этот анализ все пациенты, в том числе самые маленькие, строго натощак, а взрослые перед этим анализом не должны чистить зубы (поскольку может искажаться истинная картина).
Посев берётся с помощью специального зонда, который затем помещается в специальную среду для роста бактерий.
При конъюнктивите материал для анализа желательно брать утром до умывания. При наличии обильного гнойного отделяемого используют стерильный тампон. Гной собирают с внутренней поверхности нижнего века движением от наружного к внутреннему углу глазной щели. При этом веки нужно придерживать руками, чтобы при моргании ресницы не касались тампона. Если гной в небольшом количестве, то предварительно тампон смачивают дистиллированной водой.
При кожных заболеваниях, вызванных стафилококком, необходимо брать кожный соскоб или исследовать отделяемое из раны на наличие золотистого стафилококка. Для этого следует обработать кожу вокруг раны антисептиком или ватным тампоном, смоченным 70%-ным этиловым спиртом. Стерильной марлевой салфеткой удаляют некротические (омертвевшие) массы и гной, затем с помощью специального ватного тампона берут отделяемое из раны.
«Больничная» инфекция
Стафилококковую инфекцию называют больничной или роддомовской. У пациентов этих заведений иммунитет, как правило, ослаблен, и стафилококк на этом фоне идёт в атаку. Однако, чтобы инфекция приобрела массовый характер, у неё должен быть очаг — больной человек. Им может быть кто-то из персонала, одна из рожениц или заболевший ребёнок. Механизм передачи инфекции прост — через руки. К примеру, носитель инфекции — медсестра в роддоме. У неё есть небольшие гнойнички на коже, которым она не придала должного значения. Перепеленав или обработав новорождённого без одноразовых перчаток, эта медсестра тут же заражает его. Или же если болен ребёнок, а медсестра взяла его на руки, то заражается уже она. И может передать инфекцию следующему младенцу, с которым будет контактировать.
Для предотвращения вспышек инфекции с рук медперсонала, с мебели и оборудования регулярно делаются смывы — эпидемиологическая служба обрабатывает их специальным раствором, а потом исследует его на наличие различных бактерий, попутно выясняя степень их патогенности. С той же целью роддома два раза в год закрываются на мойку (и, естественно, это делается внепланово сразу же, как только обнаружена инфекция). При этом все поверхности, включая потолок, обрабатываются дезинфицирующими растворами, которые уничтожают бактерии стафилококка. Поэтому выбирая роддом, поинтересуйтесь, когда в последний раз он закрывался на мойку. Если это было несколько месяцев назад, может быть, имеет смысл обратиться в другой роддом.
Молоко безвредно?
Главные «ворота» для стафилококковой инфекции у женщины — трещины на сосках. Поэтому как только они появились, их нужно сразу обработать анилиновыми растворами, к которым стафилококк очень чувствителен, — зелёнка, фукорцин или метиленовый синий. Кормить ребёнка грудью при этом надо, используя специальные накладки на соски (в том числе для облегчения болезненных ощущений). Не стоит мыть молочные железы с мылом перед каждым кормлением, вполне достаточно принимать душ два раза в день. Частое мытье сушит кожу, а это в свою очередь способствует появлению новых трещин на сосках, куда может проникнуть инфекция.
Если трещина резко болезненная, воспалённая, вокруг неё появилось уплотнение, а из груди выделяется гной, то, возможно, мы имеем дело со стафилококковой инфекцией. В этом случае врач может порекомендовать сдать грудное молоко на анализ. Однако если у вас просто появились трещины — это ещё не повод бежать с молоком на анализ. Для этого должны быть симптомы воспаления (резкая пульсирующая боль в груди и гнойное отделяемое). В любом случае, стоит прийти на осмотр к врачу, который определит, что с вами, и поможет быстрее справиться с трещинами.
Если в анализе молока обнаружен эпидермальный стафилококк, скорее всего, анализ был сдан неправильно, и микроб попал туда с кожи. Если же в молоке обнаружен золотистый стафилококк, то с большой вероятностью можно утверждать, что он есть и в крови у женщины. А это уже серьезная ситуация, которая бессимптомно протекать не может, — налицо должны быть проявления бактериальной инфекции (высокая температура, слабость).
Но важно помнить, что наличие любой разновидности стафилококка в молоке (если при этом у женщины нет гнойного мастита) — не повод прекращать грудное вскармливание. Женщине в таком случае нужно будет пройти курс лечения антибиотиками, разрешёнными во время лактации, которые, попадая с грудным молоком к ребёнку, одновременно защищают его от инфекции.
Лечение
Ставить диагноз, а тем более назначать лечение при стафилококковой инфекции должен только врач. Как правило, назначаются антибиотики пенициллинового ряда и бактериофаги (микроорганизмы, избирательно поражающие бактериальные клетки).
Самая распространённая ошибка мам — это самолечение. Как только у вас или ребёнка появились гнойничковые высыпания на коже, высокая температура, понос или рвота, потеря аппетита — сразу же обращайтесь к врачу.
Самая же большая ошибка врачей — это переоценка тяжести ситуации. Если вы считаете, что ваш доктор перестраховывается, например, отменяя грудное вскармливание, не поленитесь обратиться за дополнительной консультацией к другому специалисту.
ВОПРОС ОТ ПОСЕТИТЕЛЬНИЦЫ САЙТА WWW.KROKHA.RU
У ребёнка обнаружен в кале золотистый стафилококк, при этом есть симптомы обычного дисбактериоза (небольшое нарушение стула, срыгивание, лёгкое беспокойство). Надо ли лечить стафилококк? И что в таком случае делать вообще?
НАТАЛЬЯ ТАРАН: Стафилококк не вызывает дисбактериоза. Причина появления стафилококка в анализе, скорее всего, в том, что он (анализ) был неправильно собран, и микроб попал туда с кожи. Так что в первую очередь такой анализ надо пересдать (см. выше). А затем искать и устранять причину дисбактериоза.
ПРОФИЛАКТИКА СТАФИЛОКОККОВОЙ ИНФЕКЦИИ У НОВОРОЖДЁННЫХ
Как можно быстрее выписывайтесь из родильного дома с ребёнком домой, естественно, если врачи не возражают. Во время пребывания в роддоме, если есть такая возможность, находитесь в одноместной палате и совместно с ребёнком.
Обязательно мойте руки перед кормлением и процедурами по уходу за малышом. Если у вас на руках есть порезы, царапины, то обработайте их фукорцином или зелёнкой. Ну а если на вашей коже появились гнойнички, воспалённые места, то обязательно покажите их доктору. Пока не будет выяснена их причина, за ребёнком лучше ухаживать папе или бабушке.
Внимательно наблюдайте за своим ребёнком. Подъём температуры, вялость, отказ от еды, «беспричинный» плач, высыпания на коже, понос — все это должно насторожить вас и побудить вызвать врача.
Обязательно просите всех родственников, врачей из поликлиники, которые хотят подойти и взять на руки новорождённого, тщательно вымыть руки с мылом. Выделите для них отдельное полотенце. Не стесняйтесь отказать людям, чьё здоровье внушает вам опасение.
Закаливайте малыша с первых дней жизни (см. статью в № 5 журнала «Мой кроха и Я» за 2010 г.), чтобы у него был хороший иммунитет.
Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних носовых ходов
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]MRSA и дети: часто задаваемые вопросы для родителей
Автор: Джеймс А. Уайлд, доктор медицинских наук, FAAP
Метициллин-устойчивый золотистый стафилококк (MRSA) — это стафилококковые бактерии, устойчивые к определенным антибиотикам и являющиеся одной из основных причин кожных инфекций в США как у детей, так и у детей. у взрослых.
В то время как MRSA когда-то применялась только в больницах и домах престарелых, за последние 15 лет она распространилась по всему миру, в том числе в школах, домашних хозяйствах и детских садах.
Согласно некоторым опросам, до 30% детей в классах в США имеют MRSA на коже или в носу. Первая линия защиты ребенка от MRSA — хорошо информированный родитель. Читать дальше.
Вот часто задаваемые вопросы об этой «супер-ошибке» от других родителей, таких как вы:
Как дети заражаются MRSA?
- MRSA распространяется при контакте кожа к коже или при прикосновении к предметам или поверхностям, зараженным бактериями.Как только он передается ребенку, он может либо стать переносчиком бактерий, либо развить активный инфекционное заболевание.
У большинства детей-носителей MRSA не развиваются какие-либо симптомы инфекции. Бактерии просто живут на их коже или в носу . Но они могут, например, ковырять в носу и распространять бактерии на игрушки, с которыми играют. Дети старшего возраста, занимающиеся спортом, также могут распространять бактерии MRSA через общее оборудование.
Чтобы активная инфекция MRSA закрепилась, в коже или в носу должно быть отверстие для проникновения бактерий в организм .Это может произойти из-за мелких порезов и мелких царапин, царапин при укусе насекомых, таких состояний, как экзема или даже пирсинг на теле. Как только кожа открыта, даже небольшое количество бактерий MRSA может проникнуть внутрь и начать размножаться.
Каковы признаки и симптомы инфекции MRSA?
- Обычно это начинается с шишки или инфицированной области на коже, которая кажется красной или опухшей, с гноем, теплой на ощупь или просто выглядит зараженной. Если вы или кто-то из членов вашей семьи испытываете эти признаки и симптомы, накройте область повязкой и обратитесь к врачу.Особенно важно позвонить своему врачу, когда эти признаки и симптомы сопровождаются повышением температуры тела. Посмотреть фотографии кожных инфекций MRSA можно здесь .
К наиболее распространенным кожным инфекциям, вызываемым MRSA, относятся: абсцессы, фурункулы и целлюлит. Их часто принимают за укусы пауков или могут напоминать прыщик, волдырь или сыпь. В редких случаях MRSA может привести к более серьезным инфекциям внутри организма, таким как: пневмония, костные инфекции, сепсис и менингит.
Если мой ребенок заразился MRSA, что мне делать?
- Если ваш ребенок контактирует с другим человеком, инфицированным MRSA, шансы, что у него или нее разовьется инфекция, очень низки. Если вы заметили какие-либо симптомы, упомянутые выше, позвоните своему педиатру.
Чем MRSA отличается от других инфекций, вызываемых стафилококком?
- Вот небольшая справка по этому поводу: золотистый стафилококк или «Стафилококковые» инфекции раньше легко было убить с помощью пенициллина.В конце 1940-х и на протяжении 1950-х годов все изменилось; бактерии адаптировались, и пенициллин не смог вылечить инфекцию. Ученые создали новые формы пенициллина, в том числе метициллин, чтобы решить эту проблему.
В течение многих лет метициллин и другие модифицированные формы пенициллина эффективно лечили инфекции Staph aureus. Но потому что медицинские работники назначают антибиотики слишком часто, Staph aureus снова изменился примерно в 2000 году и стал устойчивым к метициллину.Название, данное новому микробу — MRSA.
Можно ли вылечить MRSA?
- Да. При раннем лечении кожные инфекции MRSA обычно проходят. Хотя пенициллин и метициллин больше не убивают MRSA, существуют и другие антибиотики, которые действительно работают и могут применяться у детей. А иногда и вовсе не нужны антибиотики. Варианты лечения включают:
Если скопление гноя составляет дюйм или два в диаметре, ваш врач может сделать небольшой разрез или разрез на коже и выдавить гной.С остальным природа обычно справляется без антибиотиков.
У детей, инфицированных фурункулами, абсцессами или целлюлитом, врач может взять посев на культуру, чтобы определить лучший выбор антибиотика.
Если абсцесс очень маленький, иногда антибиотики могут лечить инфекцию без разреза.
Очень большие абсцессы, особенно если есть лихорадка, необходимо дренировать. Затем врач прописывает один из антибиотиков, убивающих MRSA.Иногда это можно сделать амбулаторно в больнице, но маленьким детям часто требуется кратковременная госпитализация.
Почему персонал больницы и посетители должны носить перчатки и халаты в палате человека с MRSA?
- В больнице носят халаты и перчатки, чтобы предотвратить распространение MRSA среди других пациентов; больные люди подвергаются более высокому риску заражения MRSA. Чтобы инфекция не распространялась после того, как ваш ребенок вернется домой из больницы, обязательно прикрывайте больное место ребенка (если оно есть) чистыми сухими повязками или повязками в соответствии с указаниями врача.Любые использованные бинты и повязки можно выбрасывать в обычный мусор. Если эти предметы пропитаны дренажем из раны или другими биологическими жидкостями, поместите их в пластиковый пакет и закройте его, а затем выбросьте в обычный мусор. После работы с этими предметами не забудьте хорошо вымыть руки водой с мылом или спиртовым гелем.
Могу ли я навестить кого-нибудь в больнице с MRSA во время беременности?
- Хотя необходимы дополнительные исследования MRSA и беременности, в настоящее время нет доказательств того, что воздействие Staphylococcus aureus усиливает такие осложнения, как выкидыши или врожденные дефекты.Фактически, один Исследование показало, что младенцы, рожденные от матерей, у которых на коже был MRSA, редко заболевали бактериями. Однако беременность в некоторой степени ослабляет вашу иммунную систему, поэтому важно проявлять особую осторожность, когда вы находитесь рядом с кем-то с активной инфекцией.
Если вы навещаете кого-нибудь в больнице во время беременности, всегда после этого мойте руки и надевайте маску и перчатки. По возвращении домой рекомендуется постирать одежду в воде самой горячей температуры, рекомендованной для этого.Если вы заразились инфекцией MRSA во время беременности, ее можно вылечить.
Безопасно ли бабушке с MRSA, живущей в носу, держать внуков на руках?
- Да. Риск передачи им MRSA невелик. MRSA можно заразить, прикоснувшись к носу, а затем прикоснувшись к другому человеку. Мытье рук водой с мылом или спиртовым гелем после прикосновения к носу и перед тем, как прикасаться к другим людям, поможет предотвратить распространение MRSA среди других.
Следует ли моему ребенку оставаться дома и ходить в школу, если у нее MRSA?
- Те, у кого MRSA находится только в носу или на коже, но у которых нет признаков или симптомов инфекции, могут ходить в школу и заниматься другими видами деятельности.Люди с активными кожными инфекциями MRSA также могут посещать школу IF:
Инфекция может быть покрыта повязкой или повязкой.
Весь дренаж раны можно сдерживать в течение дня без необходимости менять повязку на работе или в школе.
Инфицированный человек готов и может соблюдать правила личной гигиены и гигиены рук.
До тех пор, пока кожные инфекции не излечены, дети с кожными инфекциями MRSA не должны пользоваться гидромассажными ваннами или плавательными бассейнами, заниматься контактными видами спорта или другой физической активностью, при которой могут спасться повязки или повязки.
Если кто-то заразится MRSA, всегда ли он будет?
- Может быть. Многие люди с активными инфекциями проходят лечение и больше не болеют MRSA. Однако иногда MRSA проходит после лечения и возвращается несколько раз. Если инфекции MRSA продолжают возвращаться снова и снова, ваш врач может посоветовать вам, как остановить эти повторные инфекции или распространение инфекции среди других членов семьи.
Даже если активные инфекции пройдут, бактерии MRSA могут оставаться на коже и в носу.Это означает, что теперь вы являетесь носителем MRSA. Вы можете не заболеть или больше не иметь кожных инфекций, но вы можете передать MRSA другим людям. Не совсем понятно, почему некоторые люди являются носителями MRSA, но не заражаются инфекциями.
Запомните:
Если у вашего ребенка MRSA, научите его или ее, что значит иметь заразную инфекцию. Составьте план с вашим поставщиком услуг по уходу за детьми, чтобы снизить риск передачи MRSA другим детям. Если ваш ребенок ходит в школу, составьте план со школьной медсестрой.
Дополнительная информация:
О докторе Уайльде:
Джеймс А. Уайлд, доктор медицины, FAAP, имеет сертификаты в педиатрии, педиатрических инфекционных заболеваниях и педиатрической неотложной медицинской помощи. Он является профессором неотложной медицины и педиатрии в Детской больнице Джорджии Университета Огаста. В Американской академии педиатрии доктор Уайлд является членом секции по инфекционным заболеваниям и отделения в Джорджии.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра.Ваш педиатр может порекомендовать лечение по-разному, исходя из индивидуальных фактов и обстоятельств.
Золотистый стафилококк в миндалинах у пациентов с рецидивирующим тонзиллитом: распространенность, профиль восприимчивости и генотипическая характеристика
Резюме
Введение
Бактериальный тонзиллит — это инфекция верхних дыхательных путей, которая встречается в основном у детей и подростков. Золотистый стафилококк является одним из наиболее частых возбудителей этиологии тонзиллита, и его значимость связана с его устойчивостью к противомикробным препаратам и устойчивостью во внутренних тканях миндалин.Тонзиллэктомия показана при рецидиве тонзиллита после нескольких неудачных попыток антибактериальной терапии.
Материалы и методы
В этом исследовании мы оценили 123 хирургически удаленных миндалин у пациентов с рецидивирующим тонзиллитом в анамнезе. Миндалины были подвергнуты микробиологическому анализу на обнаружение S. aureus . Изоляты идентифицировали с помощью ПЦР для гена fem A. Чувствительность изолятов к противомикробным препаратам определяли с помощью диско-диффузионных тестов.Все изоляты были подвергнуты ПЦР для обнаружения генов mec A и лейкоцидина Пантона-Валентайна (PVL). Генетическое сходство среди всех изолятов определяли с помощью гель-электрофореза в импульсном поле.
Результаты
Шестьдесят один изолят S. aureus был получен от 50 пациентов (40,7%) со средним возрастом 11,7 лет. Изоляты показали высокий уровень устойчивости к пенициллину (83,6%), 9,8% имели индуцибельный фенотип MLSb, а 18,0% были признаны множественной лекарственной устойчивостью (МЛУ). mec Ген был обнаружен в двух изолятах, а ген, кодирующий PVL, был идентифицирован в одном изоляте. Анализ генетического сходства показал высокое разнообразие изолятов. От одного и того же пациента было идентифицировано более одного генетически различающегося изолята, и идентичные изоляты были получены от разных пациентов.




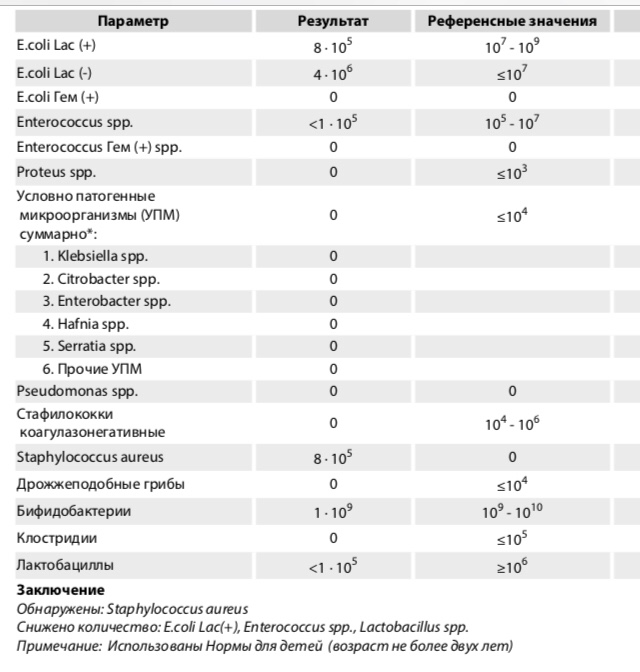 Устанавливайте для сушилки режим высокой температуры, чтобы убить оставшиеся бактерии.
Устанавливайте для сушилки режим высокой температуры, чтобы убить оставшиеся бактерии.
 Человек испытывает необходимость в постоянном сглатывании. Отмечается легкое покашливание, жжение в горле. Локальная симптоматика заболевания нарастает на протяжении нескольких часов, а может затянуться до нескольких дней. Затем инфекционный процесс перетекает в более выраженную форму.
Человек испытывает необходимость в постоянном сглатывании. Отмечается легкое покашливание, жжение в горле. Локальная симптоматика заболевания нарастает на протяжении нескольких часов, а может затянуться до нескольких дней. Затем инфекционный процесс перетекает в более выраженную форму.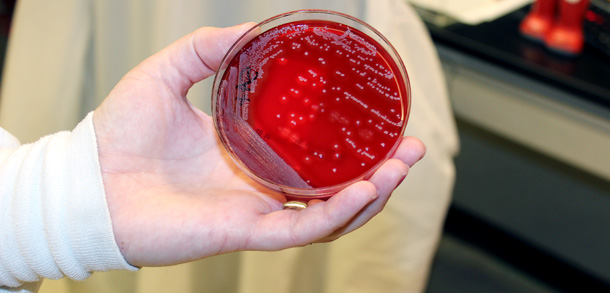
 Общая продолжительность составит 7-10 дней.
Общая продолжительность составит 7-10 дней. Его принимать 100 г 2 раза в сутки. Взять 20 г и залить 200 мл кипятка. Перед употреблением настой необходимо отфильтровать.
Его принимать 100 г 2 раза в сутки. Взять 20 г и залить 200 мл кипятка. Перед употреблением настой необходимо отфильтровать. Читайте инструкцию к Октенисепту.
Читайте инструкцию к Октенисепту.