Врожденные пороки сердца — РИА Новости, 01.07.2016
Врожденный порок сердца можно диагностировать на 16-й неделе беременности с высокой долей вероятности, а на 21-22-й неделе на 100% случаев можно назвать, какой это врожденный порок.При большом количестве разнообразных ВПС семь из них встречаются наиболее часто: дефект межжелудочковой перегородки (ДМЖП) составляет около 20% всех случаев врожденных пороков сердца, дефект межпредсердной перегородки (ДМПП), открытый артериальный порок (ОАП), коарктация аорты, стеноз аорты, стеноз легочной артерии и транспозиция крупных магистральных сосудов (ТКС) — по 10-15% каждый.
Существует более 100 различных врожденных пороков сердца. Последняя классификация, использующаяся в России, соответствует Международной классификации болезней. Часто используется разделение пороков на синие, сопровождающиеся синюшностью кожи, и белые, при которых кожные покровы бледной окраски. К порокам синего типа относится тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии, к порокам белого типа — ДМЖП, ДМПП и другие.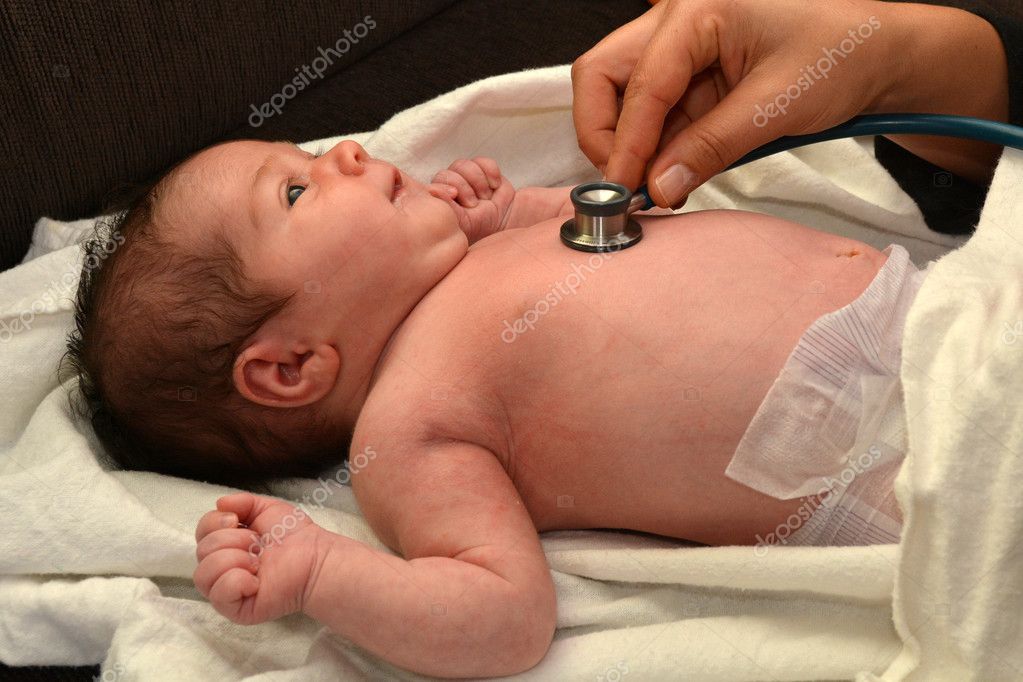
Чем раньше выявлен врожденный порок сердца, тем больше надежды на своевременное его лечение. Врач может заподозрить наличие у ребенка порока сердца по нескольким признакам: ребенок при рождении или вскоре после рождения имеет голубой или синюшный цвет кожи, губ, ушных раковин. Или синюшность появляется при кормлении грудью, крике малыша. При белых пороках сердца может возникнуть побледнение кожи и похолодание конечностей. Врач при прослушивании сердца выявляет шумы, но шум у ребенка не обязательный признак порока сердца.
Ребенок с врожденным пороком сердца может выглядеть внешне вполне здоровым в течение первых десяти лет жизни. Однако в дальнейшем порок сердца начинает проявлять себя: малыш отстает в физическом развитии, появляется одышка при физических нагрузках, бледность или синюшность кожи. Для установки истинного диагноза необходимо комплексное обследование сердца с применением современного высокотехнологичного оборудования.
По статистике 36% новорожденных, у которых есть порок сердца, умирают в течение первого месяца жизни, еще 35,5% — в течение последующих 11 месяцев. Таким образом, фактически из 100 детей, которые родились с ВПС, в течение первого года почти 72% нуждаются в операции.
Таким образом, фактически из 100 детей, которые родились с ВПС, в течение первого года почти 72% нуждаются в операции.
В настоящее время с хирургической точки зрения неоперабельных пороков сердца нет — есть различные состояния, которые возникают в результате развития порока у ребенка. Главное — вовремя прооперировать самые сложные пороки сердца. 97% вовремя прооперированных детей проживают полноценную жизнь. Большинство этих операций проводится на остановленном сердце с использованием аппарата искусственного кровообращения (АИК). Сделать такие операции максимально щадящими — самое главное направление развития сердечно-сосудистой хирургии. Некоторые большие полостные операции заменены эндоваскулярными. Теперь после эндоваскулярной операции ребенка выписывают на третий день.
В России головным учреждением страны по проблеме «Сердечно-сосудистая хирургия» является Научный центр сердечно-сосудистой хирургии имени А.Н. Бакулева. Центр осуществляет диагностику, консервативное, интервенционное и хирургическое лечение больных врожденными пороками сердца.
Отделение детской кардиохирургии и врожденных пороков сердца ведет работу в Новосибирском научно-исследовательском институте патологии кровообращения имени академика Е.Н. Мешалкина. Специалистами выполняется хирургическое лечение всех ВПС у пациентов любой возрастной группы.
Функции головного учреждения по проблемам кардиологии в Сибири и на Дальнем Востоке выполняет Научно-исследовательский институт кардиологии в Томске. В институте выполняются все виды кардиохирургической, рентгенохирургической и аритмологической помощи взрослым и детям, начиная с первых дней жизни.
Отделение кардиохирургии для детей Детской городской клинической больницы N13 имени Н.Ф. Филатова в Москве выполняет около 400 операций в год, включая рентгенохирургические процедуры по устранению врожденных пороков сердца детям.
В отделении кардиохирургии Детской городской больницы N1 Санкт-Петербурга было выполнено более шести тысяч операций на открытом сердце. Ежегодно в отделении оперируется 600 детей с врожденными пороками сердца. Отделение оказывает помощь не только жителям Санкт-Петербурга, но и принимает детей из регионов РФ и стран ближайшего зарубежья.
Отделение оказывает помощь не только жителям Санкт-Петербурга, но и принимает детей из регионов РФ и стран ближайшего зарубежья.
В ведущую тройку российских кардиохирургических центров входит Самарский областной клинический кардиологический диспансер (СОККД).
Самые современные хирургические и миниинвазивные методы лечения врожденных пороков сердца есть в крупных специализированных центрах практически во всех странах мира. Особо выдающихся результатов в лечении врожденных пороков сердца у детей достигла детская кардиохирургия в Израиле и Германии.
В Израиле на базе Института сердца МЦ «Хадасса» действует Центр детской кардиологии и кардиохирургии. Среди известных израильских клиник, занимающихся хирургическим лечением врожденных пороков сердца, — Детская больница Сафра Государственного медицинского центра им. Хаима Шиба, Детская больница Майер на базе медицинского комплекса Рамбам, клиника «Ассута» и др.
Кардиологическая клиника Шарите в Берлине (Германия) — известный во всем мире университетский клинический комплекс. Клиника специализируется на диагностике и лечении пациентов с ВПС.
Клиника специализируется на диагностике и лечении пациентов с ВПС.
Немецкий центр сердечно-сосудистой хирургии в Западном Берлине проводит более 400 операций в год при врожденных пороках сердца.
Также хирургическим лечением врожденных пороков сердца занимается Мюнхенский кардиологический центр на Изаре, отделение кардиологии клиники Ammerland, расположенное в Вестерштеде. Оперативной корректурой врожденного порока сердца занимается отделение детской сердечной хирургии кардиологического центра в Аугсбурге, а также клиника торакальной и сердечно-сосудистой хирургии Униклиники Саарланд в городе Хомбург.
Международный уровень детской кардиохирургии можно найти в клиниках Франции, Австрии, Южной Кореи, Индии, Турции. В США лечением врожденного порока сердца занимается Медицинский центр Детской больницы Цинциннати.
Среди отечественных благотворительных фондов, оказывающих помощь детям с врожденным порокам сердца, наиболее известны Русфонд, Региональный благотворительный общественный фонд «Детские сердца», интернет-фонд «Помоги. org», Благотворительный фонд «Калин фонд», Межрегиональный общественный фонд «Доброе сердце» и др.
org», Благотворительный фонд «Калин фонд», Межрегиональный общественный фонд «Доброе сердце» и др.
Какие бывают пороки, и к чему они приводят после рождения ребенка
Специалистам известно более 100 видов врожденных пороков сердца и сосудов. Некоторые из них являются относительно простыми по анатомии и тяжести проявления заболевания после рождения ребенка. К таким порокам можно отнести открытый артериальный проток (сообщение между аортой и легочной артерией, которое в норме должно закрываться практически сразу после рождения ребенка), дефекты межпредсердной и межжелудочковой перегородок (отверстия в перегородках сердца, которых не должно быть в норме), незначительные изменения клапанов сердца. Дети с такими пороками находятся под тщательным наблюдением кардиологов, при необходимости им назначается соответствующее лечение. Дефекты небольших размеров, как правило, не нарушают нормальной работы сердца, не мешают росту и развитию ребенка и, нередко, самопроизвольно закрываются в первый год жизни.
Однако существует большая группа пороков, гораздо более сложных и опасных, как с точки зрения структурных нарушений в сердце, так и по тяжести состояния детей после рождения . Это грубые нарушениями в строении и расположении главных кровеносных сосудов, такие как транспозиция магистральных артерий (когда аорта и легочная артерия меняются местами друг с другом), отхождение сосудов от одного (чаще правого) желудочка сердца, общий артериальный ствол, тетрада Фалло и некоторые другие. К серьезным аномалиям развития сердца относятся также грубые изменения в строении клапанов сердца: окрытый атрио–вентрикулярный канал, критические стенозы и атрезии клапанов.
При любом из таких пороков стремительно развивается и нарастает сердечная недостаточность. Сердце оказывается не в состоянии обеспечить кислородом и питательными веществами ткани организма, с чем связано крайне тяжелое состояние детей сразу после рождения. Эти пороки являются несовместимыми с жизнью и достаточно быстро приводят к гибели ребенка в том случае, если ему не будет проведена хирургическая операция. Некоторые из этих пороков специалисты называют “критическими”, т.е. требующими хирургического вмешательства в первые дни, а иногда и часы жизни ребенка.
От чего зависит успех операции
В связи с интенсивным развитием кардиохирургии, как в мире в целом, так и в нашей стране, большинство таких тяжелых пороков сегодня успешно оперируется, несмотря на высочайшую степень сложности таких операций. Однако важно отметить, что успех хирургического лечения напрямую зависит от того, насколько оперативно ребенок был доставлен в специализированную клинику, а также от правильного выбора тактики его лечения в первые часы или дни до операции. Упущенное драгоценное время, которое тратится на постановку диагноза, и связанные с этим тактические ошибки в лечении таких больных, приводят к развитию тяжелых нарушений во всем организме, что часто является причиной неудачного исхода операции. Именно поэтому о наличии у ребенка врожденного порока сердца необходимо знать задолго до его рождения. Это дает возможность врачам правильно определить тактику ведения беременности, организовать проведение родов в специализированном роддоме, максимально рано доставить новорожденного в кардиохирургический стационар и вовремя оказать ему специализированную помощь по подготовке к операции.
ВПС — причины и факторы риска
Частота врожденных пороков сердца достаточна высока. У разных авторов оценка частоты встречаемости колеблется, но, в среднем, она составляет 0,8 — 1,2% от всех новорожденных. Из числа всех встречающихся пороков развития она составляет до 30%. Врожденные пороки сердца (ВПС) представляют собой весьма обширную и разнородную группу заболеваний, в которую входят как относительно легкие формы, так и состояния, несовместимые с жизнью ребенка. Основная масса детей погибает в течение первого года жизни (до 70-90%). После первого года жизни смертность резко снижается, и в период от 1 года до 15 лет погибают не более 5% детей. Понятно, что это большая и серьезная проблема. Мы с вами рассмотрим только некоторые ее аспекты.
Прежде всего, какие причины могут приводить к рождению ребенка с ВПС. Некоторыми исследованиями показано, что существует определенная сезонность в рождении детей с ВПС. Например, есть данные, что открытый артериальный проток встречается преимущественно у девочек, родившихся во второй половине года, чаще всего с октября по январь.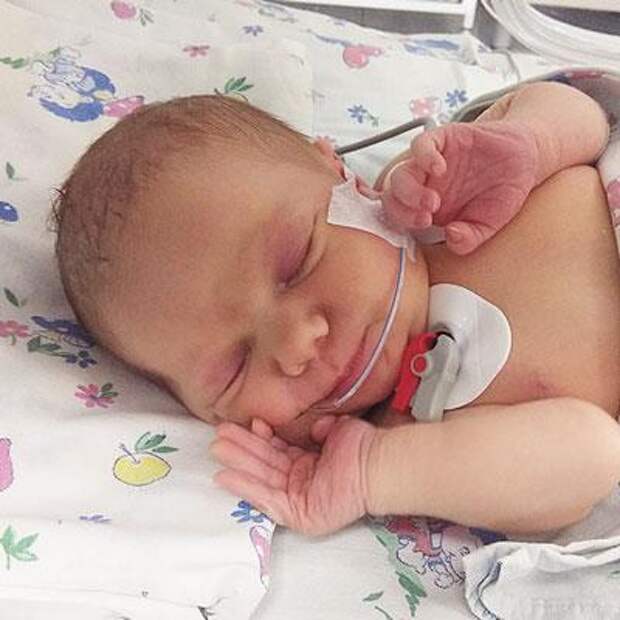 Мальчики с коарктацией аорты чаще рождаются в марте и апреле, наиболее редко — в сентябре и октябре. Бывают случаи, когда в определенной географической зоне рождается большое число детей с ВПС, что создает впечатление определенного рода эпидемии.
Мальчики с коарктацией аорты чаще рождаются в марте и апреле, наиболее редко — в сентябре и октябре. Бывают случаи, когда в определенной географической зоне рождается большое число детей с ВПС, что создает впечатление определенного рода эпидемии.
Сезонные колебания возникновения ВПС и т.н. эпидемии, скорее всего, связаны с вирусными эпидемиями, а также воздействие экологических факторов (в первую очередь, ионизирующей радиации), оказывающих тератогенное (т.е. неблагоприятное для плода) действие. Так, например, доказано тератогенное действие вируса краснухи. Есть предположение, что и вирусы гриппа, а также некоторые другие, могут иметь значение в возникновении ВПС, в особенности, если их действие приходится на первые 3 месяца беременности. Безусловно, одного лишь наличия вирусного заболевания еще недостаточно для того, чтобы у будущего ребенка развился порок сердца, однако при условии дополнительных факторов (тяжести вирусного, да и бактериального заболевания, наличия генетической предрасположенности к неблагоприятным реакциям на пусковое воздействие данного фактора) вирусный агент может оказаться решающим в плане формирования врожденного порока сердца у новорожденного.
Определенную роль в возникновении ВПС играет хронический алкоголизм матери. У 29 — 50% таких матерей рождаются дети с ВПС. У матерей, болеющих системной красной волчанкой, часто рождаются дети с врожденной блокадой проводящих путей сердца. Недостаток питательных веществ не влияет на образование пороков сердца у людей. У женщин, страдающих диабетом или преддиабетом, чаще, чем у здоровых, рождаются дети с пороками сердца.
Обычно встречаются дефект межжелудочковой перегородки и транспозиция крупных сосудов. Особое значение имеет прием лекарственных препаратов во время беременности. В настоящее время абсолютно отказались от приема талидомида — этот препарат вызывал многочисленные врожденные уродства во время беременности (в том числе, и врожденные пороки сердца). Кроме того, тератогенным эффектом обладают алкоголь (вызывает дефекты межжелудочковой и межпредсердной перегородок, открытый артериальный проток), амфетамины (образуются чаще ДМЖП и транспозиция крупных сосудов), противосудорожные препараты — гидантоин (стеноз легочной артерии, коарктация аорты, открытый артериальный проток) и триметадион (транспозиция магистральных сосудов, тетрада Фалло, гипоплазия левого желудочка), литий (аномалия Эбштейна, атрезия трехстворчатого клапана), прогестагены (тетрада Фалло, сложные ВПС).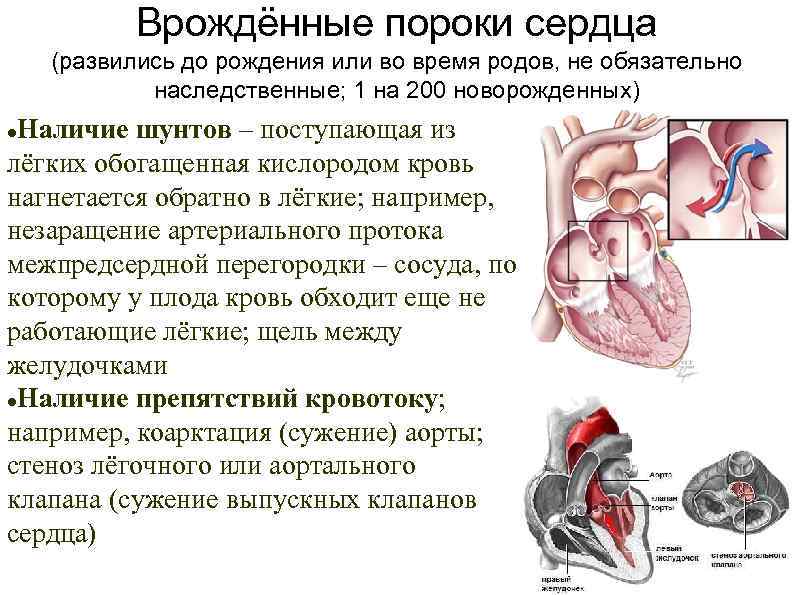 Существует общее мнение, что наиболее опасными для развития ВПС являются первые 6-8 недель беременности. При попадании тератогенного фактора в этот промежуток наиболее вероятно развитие тяжелого или сочетанного врожденного порока сердца. Однако не исключена возможность менее комплексного поражения сердца либо некоторых его структур на любом этапе беременности. Несомненным фактором риска является наличие генетической предрасположенности. Дать точную количественную оценку риска рождения ребенка с ВПС может (да и то не всегда) только генетик в процессе проведении медико-генетического консультирования. Факторами риска рождения ребенка с ВПС таким образом являются: возраст матери, эндокринные нарушения у супругов, токсикозы в I триместре и угрозы прерывания беременности, мертворождения в анамнезе, наличие других детей с врожденными пороками развития, прием женщиной эндокринных препаратов для сохранения беременности и др.
Существует общее мнение, что наиболее опасными для развития ВПС являются первые 6-8 недель беременности. При попадании тератогенного фактора в этот промежуток наиболее вероятно развитие тяжелого или сочетанного врожденного порока сердца. Однако не исключена возможность менее комплексного поражения сердца либо некоторых его структур на любом этапе беременности. Несомненным фактором риска является наличие генетической предрасположенности. Дать точную количественную оценку риска рождения ребенка с ВПС может (да и то не всегда) только генетик в процессе проведении медико-генетического консультирования. Факторами риска рождения ребенка с ВПС таким образом являются: возраст матери, эндокринные нарушения у супругов, токсикозы в I триместре и угрозы прерывания беременности, мертворождения в анамнезе, наличие других детей с врожденными пороками развития, прием женщиной эндокринных препаратов для сохранения беременности и др.
Профилактика ВПС
Профилактика при ВПС может быть условно разделена на профилактику возникновения врожденных пороков сердца, профилактику неблагоприятного развития ВПС и профилактику осложнений врожденных пороков сердца.
Профилактика возникновения ВПС очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди контингента повышенного риска заболевания. Так, например, если 3 человека из одной семьи, состоящие в прямом родстве, имеют ВПС, то вероятность появления следующего случаю составляет 65-100%, и в таких случаях, понятно, беременность не рекомендуется. Нежелателен также брак между двумя людьми с ВПС. Кроме этого, необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, способную привести к развитию врожденных пороков сердца. Профилактика неблагоприятного развития ВПС в основном сводится к своевременному установлению порока, обеспечению надлежащего ухода за ребенком и определения оптимального метода коррекции порока (чаще всего, это хирургическая коррекция ВПС). Обеспечение необходимого ухода — очень важная часть в лечении и профилактике неблагоприятного развития. Почти до половины случаев смерти детей до 1-го года, во многом были обусловлены недостаточно адекватным и грамотным уходом за больным ребенком. Необходимо также отметить, что, за исключением критических случаев угрозы жизни ребенка, специальное лечение (в том числе, кардиохирургическое) должно проводиться не немедленно по выявлению порока, и не в самые ранние сроки, а в наиболее оптимальные сроки, которые зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Необходимо также отметить, что, за исключением критических случаев угрозы жизни ребенка, специальное лечение (в том числе, кардиохирургическое) должно проводиться не немедленно по выявлению порока, и не в самые ранние сроки, а в наиболее оптимальные сроки, которые зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Профилактика осложнений врожденных пороков сердца определяется прежде всего самими этими осложнениями. Грозным осложнением ВПС является, к примеру, бактериальный эндокардит, который может осложнить любой вид порока и может появиться уже в дошкольном возрасте. При некоторых видах пороков может развиться полицитемия («сгущение крови»), что может стать причиной частых головных болей, а также тромбозов и воспаления периферических сосудов и тромбоэмболии сосудов головного мозга. Нередки осложнения со стороны легких, начиная от частых респираторных заболеваний и до весьма серьезных осложнений со стороны легочных сосудов и легких.
Физическая нагрузка больных с врожденным пороком сердца.
Сердце у пациентов с врожденным пороком сердца даже в состоянии покоя испытывает увеличенную нагрузку, с которой часто не может справиться, что и приводит к развитию сердечной недостаточности. Прежде по этим причинам физическая активность всех детей с ВПС ограничивалась. Теперь подходы изменились. Не следует ограничивать подвижность детей с ВПС без особых оснований. Существует очень небольшое число ВПС, при которых требуется ограничение физической нагрузки, несмотря на то, что эти дети способны проявить значительное физическое усилие. Детям старшего возраста с не очень серьезным пороком даже не запрещается участие в спортивных играх и активном отдыхе. Ограничение по сути только одно: категорически запрещается участие в спортивных соревнованиях. При очень серьезных же пороках, как правило, тяжелое общее состояние больного само по себе не позволяет увеличивать физическую активность. С регулированием физической активности связан и выбор профессии.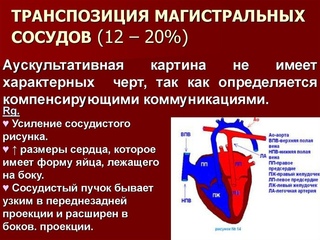
Необходимо принимать в этом случае во внимание также другие потенциально неблагоприятные факторы, например, плохое влияние высокой температуры при определенных пороках сердца. По этим соображением, при выборе профессии у этих больных необходимо учитывать мнение кардиолога. И последний нюанс, который хотелось бы затронуть — это беременность у женщин с врожденным пороком сердца. Эта проблема стоит сейчас достаточно остро, в силу своей сложности и, не такой уж малой распространенности, особенно после того как пролапсы митрального клапана стали причисляться к «малым порокам сердца» и на них стали распространяться приказы и распоряжения МЗ в отношении тактики ведения беременных женщин с ВПС.
В целом, за исключением анатомически и гемодинамически компенсированных пороков, при всех ВПС беременность связана с риском осложнений. Правда, все зависит от конкретного порока и степени компенсации. При некоторых ВПС (например, при дефекте межжелудочковой перегородки и стенозе аорты) увеличение нагрузки во время беременности может привести к развитию сердечной недостаточности.
При беременности повышена склонность к образованию сосудистых аневризм, вплоть до разрывов сосудистой стенки. У женщин с высокой легочной гипертензией чаще фиксируются выкидыши, тромбозы вен, и даже внезапная смерть. Поэтому вопрос в каждом случае решается индивидуально, и лучше решать его заблаговременно, так как кардиохирургическое вмешательство (в том числе, и для коррекции порока) во время беременности не показано.
Врожденный порок сердца (ВПС) / Заболевания / Клиника ЭКСПЕРТ
Врождённый порок сердца (ВПС) — это дефект в структуре сердца и крупных сосудов, возникающий ещё до рождения.
Эти дефекты возникают уже на стадии развития плода в матке, и возможность рождения с ВПС среди новорожденных составляет около 1% (1 на 100 новорожденных).
Симптомы врожденного порока сердца могут появиться как при рождении, так и в детстве, а иногда и до достижения пациентом совершеннолетнего возраста. Согласно статистическим данным около 500 000 взрослых имеют врожденный порок сердца. Каждому из них, разумеется, нужны регулярные обследования у врача кардиолога.
Каждому из них, разумеется, нужны регулярные обследования у врача кардиолога.
Что вызывает врожденный порок сердца?
У большинства людей причины врожденного порока сердца остаются неизвестными. Однако существуют некоторые факторы, связанные с увеличением шансов рождения ребёнка с врожденным пороком. Эти факторы риска включают в себя:
- такие генетические или хромосомные аномалии у ребенка, как, например, синдром Дауна
- приём определенных лекарств, алкоголя или наркотиков во время беременности
- материнские вирусные инфекции, такие, как краснуха (лат. Rubella, 3-я болезнь) в первом триместре беременности.
- риск рождения ребенка с врожденным пороком сердца намного выше, если его родители или братья имеют ВПС
Проблемы, связанные с врожденным пороком сердца
Чаще всего встречаются такие проблемы, как:
- Дефекты сердечных клапанов. Сужение (стеноз) клапанов или их полное закрытие затрудняет или делает невозможным бесперебойную работу системы кровообращения.
 Другие пороки клапанов приводят к тому, что они не закрываются правильно и позволяют крови течь в обратном направлении.
Другие пороки клапанов приводят к тому, что они не закрываются правильно и позволяют крови течь в обратном направлении. - Дефекты межпредсердной и межжелудочковой перегородок. Эти дефекты создают градиент давлений между желудочками, вследствие чего сброс крови происходит слева-направо.
- Нарушения в сердечной мышце, что может привести к сердечной недостаточности.
Какие симптомы врожденного порока сердца наблюдаются у взрослых?
При наличии порока сердца возможно даже полное отсутствие каких либо симптомов. У взрослых людей, могут присутствовать такие симптомы, как:
- одышка
- ограниченные физические возможности
Диагностика врождённого порока сердца
Врожденный порок сердца зачастую обнаруживается, когда врач при осмотре замечает необычный звук или шумы в сердце. В зависимости от типа этого шума ваш доктор может назначит вам лабораторно-инструментальное исследование.
Среди ведущих методик диагностики можно выделить:
- эхокардиограмма или УЗИ сердца (основная методика, позволяющая увидеть морфологию порока и определить функциональное состояние сердца)
- сердечное зондирование
- рентгенограмма грудной клетки
- электрокардиограмма (ЭКГ)
- магниторезонансная томография (МРТ).

Как лечится врожденный порок сердца?
Лечение зависит от тяжести ВПС. Врожденные пороки сердца средней тяжести не требуют никакого лечения. Другие же можно лечить при помощи лекарств, процедур или хирургического вмешательства. Большинство взрослых с врожденными пороками сердца на протяжении всей жизни должны регулярно наблюдаться у специалистов и принимать меры предосторожности для предотвращения эндокардита (серьезного воспаления внутренней оболочки сердца).
Как можно предотвратить эндокардит?
Люди с врожденным пороком сердца подвержены риску получить эндокардит, даже если их сердце было подвержено тщательному лечению или пересадке. Чтобы защитить себя от эндокардита, говорите на приёме у любого врача или стоматолога, что у вас врожденный порок сердца.
- Позвоните своему врачу, если у вас появились симптомы инфекции (боль в горле, слабость, лихорадка).
- Позаботьтесь о ваших зубах и деснах, чтобы защититься от инфекции.
- Принимайте антибиотики перед тем, как подвергнуться каким-либо процедурам, которые могут вызвать кровотечение, например: стоматологическая помощь, анализы (любые анализы, которые могут быть связаны со сбором крови или которые могут вызвать кровотечение), хирургические операции.
 Проконсультируйтесь со своим врачом о типе и количестве антибиотика, который вам следует принять.
Проконсультируйтесь со своим врачом о типе и количестве антибиотика, который вам следует принять.
Коррекция врожденного порока сердца
ВАМ ИЛИ ВАШЕМУ РЕБЕНКУ НАЗНАЧЕНА КОРРЕКЦИЯ ВРОЖДЕННОГО ПОРОКА СЕРДЦА. ЧТО ЭТО ЗНАЧИТ?Сегодня врожденные пороки сердца (ВПС) занимают лидирующие позиции среди врожденных пороков развития. Выделяют критические ВПС, требующие хирургии в первые часы-дни жизни ребенка и пороки, которые можно прооперировать в плановом порядке.
ВЗРОСЛЫЕ И ДЕТИ. КОГДА ПРОВОДЯТСЯ ОПЕРАЦИИ?
Современные возможности медицины позволяют выявить и вылечить врожденный порок сердца на максимально-ранних стадиях. Чем старше становится человек с диагнозом врожденный порок сердца, тем чаще врачи сталкиваются еще и с сопутствующими, коморбидными заболеваниями, повышающими риски для оперативного вмешательства. Например, «изношенность» миокарда и наличие сопутствующих заболеваний (сахарный диабет, заболевания легких, печени, почек и пр. ), как правило, осложняет, как проведение самой операции, так и течение послеоперационного периода, повышая риски присоединения осложнений, а также в целом ухудшает ближайшие и отдаленные результаты проведенной операции на сердце. Очень часто у взрослых, операции по поводу врожденных пороков — это повторные и этапные операции. Риск по поводу ВПС у взрослых, по сравнению с операцией в детстве, существенно выше. Сегодня по статистике, остаются только две причины, по которым ребенок оказался непрооперированным:
), как правило, осложняет, как проведение самой операции, так и течение послеоперационного периода, повышая риски присоединения осложнений, а также в целом ухудшает ближайшие и отдаленные результаты проведенной операции на сердце. Очень часто у взрослых, операции по поводу врожденных пороков — это повторные и этапные операции. Риск по поводу ВПС у взрослых, по сравнению с операцией в детстве, существенно выше. Сегодня по статистике, остаются только две причины, по которым ребенок оказался непрооперированным:
- Не выявленный своевременно ВПС у ребенка в детском возрасте.
- Отказ родителей от операции
Существует 2 подхода к лечению врожденных пороков сердца: открытая хирургия и эндоваскулярные вмешательства. Выбор подхода зависит от анатомии пророка сердца и от нарушений гемодинамики.
КАРДИОХИРУРГИЯ НОВОРОЖДЕННЫХ (ХИРУРГИЯ КРИТИЧЕСКИХ СОСТОЯНИЙ)
Существующие в нашем отделении технологии позволяют проводить операции на открытом сердцем у новорожденных с низким весом и критическом состоянии. При этом, наши детские кардиологи, при необходимости, консультируют беременных при перинатально-диагностированных тяжелых врожденных пороках сердца. В рамках междисциплинарного сотрудничества беременные женщины с ВПС у плода, в т.ч. из других регионов России направляются (по предварительному согласованию) для родоразрешения в ГБУЗ «Областной перинатальный центр» г.Челябинска. При подтверждении показаний к операции после рождения ребенка, операция на сердце новорожденному проводится в условиях ФЦССХ.
При этом, наши детские кардиологи, при необходимости, консультируют беременных при перинатально-диагностированных тяжелых врожденных пороках сердца. В рамках междисциплинарного сотрудничества беременные женщины с ВПС у плода, в т.ч. из других регионов России направляются (по предварительному согласованию) для родоразрешения в ГБУЗ «Областной перинатальный центр» г.Челябинска. При подтверждении показаний к операции после рождения ребенка, операция на сердце новорожденному проводится в условиях ФЦССХ.
КАРДИОХИРУРГИЯ НА ПЕРВОМ ГОДУ ЖИЗНИ
Современная концепция коррекции врожденных пороков сердца в большинстве случаев предполагает проведение операций в течении первого года жизни ребенка для исключения прогрессирования легочной гипертонии и сердечной недостаточности.
Маленький вес и возраст ребенка при наличии показаний не препятствуют проведению операции. В этом возрасте возможны операции при ВПС: дефект межжелудочковой перегородки сердца, полный атрио-вентрикулярный канал, атрезия легочной артерии, Тетрада Фалло, двойное отхождение магистральных сосудов от правого желудочка, транспозиция магистральных сосудов и критические стенозы клапанов сердца.
В силу большого разнообразия возможных комбинаций сложных пороков для каждого ребенка подбирается индивидуальный план лечения после проведения развернутой диагностики.
ЭТАПНОЕ ЛЕЧЕНИЕ СЛОЖНЫХ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА И ПОВТОРНЫЕ КАРДИОХИРУРГИЧЕСКИЕ ВМЕШАТЕЛЬСТВА
Одним из направлений нашей работы является диагностика, лечение и ремоделирование сердца при пороках правого желудочка сердца. В этот перечень входят пороки из группы тетрады Фалло (вплоть до атрезии легочной артерии), пороки с двойным отхождением магистральных сосудов от правого желудочка, операция Растрелли, аномалия Эбштейна и прочие, включая большие группы операций с одножелудочковой гемодинамикой.
Хорошие результаты достигаются после коррекции тяжелых пороков сердца по методу Фонтена. Такая операция проводится в детском возрасте с применением экстра кардиального кондуита.
МИНИМАЛЬНО ИНВАЗИВНАЯ ХИРУРГИЯ
В нашем Центре реализуется максимально щадящий подход в выборе метода и вида оперативного вмешательства на сердце у детей.
При наличии медицинских показаний предпочтение отдается малоинвазивным эндоваскулярным методам лечения, которые, в отличие от открытых оперативных вмешательств не требуют торакотомии, остановки сердца и подключения аппарата искусственного кровообращения. Эндоваскулярные вмешательства занимают по времени от 1 часа до 1,5 часов, хорошо переносятся детьми, при этом пребывание в стационаре не превышает 3 дней.
Маленьким детям операции проводятся под наркозом, более старшим — под местным обезболиванием.
Дефекты межпредсердной и межжелудочковой перегородок закрываются специальными устройствами — окклюдерами, сплетёнными из тонкой металлической проволоки с эффектом памяти формы. Подведённые к нужному месту по тонкой трубочке (катетеру) окклюдеры принимают необходимую конфигурацию при их выдвижении из катетера. Основное условие выбора такого способа лечения — наличие достаточных краёв у дефекта, что определяется при предварительном ультразвуковом исследовании.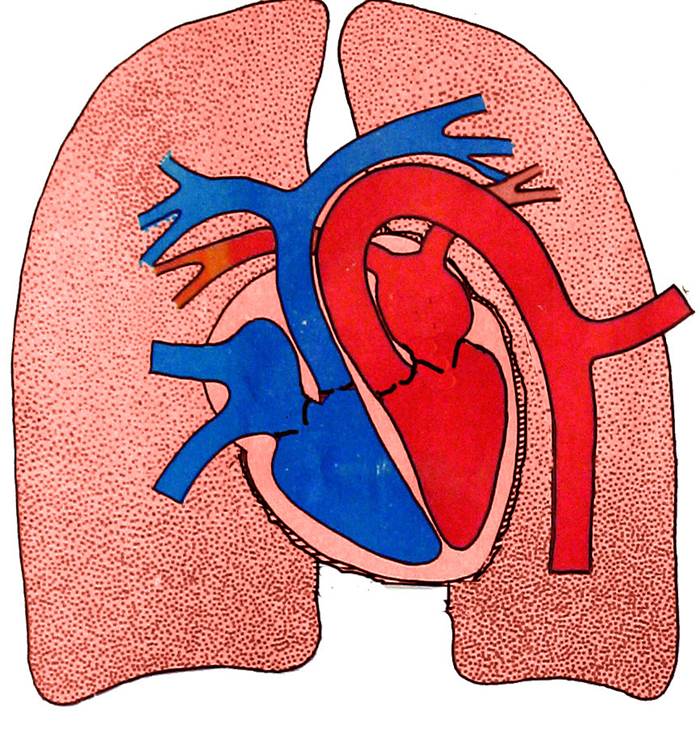 При наличии дефицита краев у дефекта (ДМПП, ДМЖП), необходима открытая операция.
При наличии дефицита краев у дефекта (ДМПП, ДМЖП), необходима открытая операция.
При врожденном пороке сердца: открытый артериальный проток в зависимости от размера он закрывается или окклюдером, или специальной платиновой спиралью.
ПРЕБЫВАНИЕ В ОТДЕЛЕНИИ
В детском отделении (КХО№4) созданы все условия для комфортного совместного пребывания матери и ребенка. В каждой палате есть встроенная мебель, душевая комната, функциональные кровати, централизованная система вентиляции и кондиционирования воздуха, телевизор, система видеонаблюдения, кнопка вызова медицинского персонала.
Для детей находящихся на искусственном вскармливании в отделении организована молочная комната, в которой предусмотрено приготовление и розлив детских молочных смесей, а также созданы все условия для сцеживания материнского молока.
И, кроме того, создана максимально комфортная среда пребывания, приближённая к домашней, доброжелательная и уютная обстановка. Имеется прекрасная игровая комната. В этой комнате комфортную атмосферу для детей создали 2 дизайнера, приглашенные из Лондона.
Имеется прекрасная игровая комната. В этой комнате комфортную атмосферу для детей создали 2 дизайнера, приглашенные из Лондона.
Тяжелые врожденные пороки сердца у недоношенных детей с низким весом теперь совместимы с жизнью
Пороки сердца у недоношенных и глубоко недоношенных детей с экстремально низким весом
Госпиталь Сант Жоан де Деу является ведущим медицинским центром по лечению врожденных пороков сердца у недоношенных и глубоко недоношенных детей с экстремально низким весом.
В 2017 году команда кардиохирургов госпиталя Сант Жоан де Деу в Барселоне впервые провела операцию на открытом сердце недоношенному младенцу, рожденному на 32 неделе беременности весом всего 1370 граммов.
Ему был исправлен серьезный врожденный порок сердца, который мог бы привести к его смерти.
Врожденные пороки сердца представляют собой группу заболеваний, характеризующихся наличием структурных изменений в сердце. Эти нарушения возникают при формировании сердца во время эмбрионального развития. Они появляются у 8 из 1000 живых новорожденных. Симптомы, связанные с пороками сердца, очень различны, и даже есть случаи, когда вообще нет проявления симптомов, но также есть и те случаи, в которых требуется хирургическое вмешательство в течение первых недель жизни ребенка.
Они появляются у 8 из 1000 живых новорожденных. Симптомы, связанные с пороками сердца, очень различны, и даже есть случаи, когда вообще нет проявления симптомов, но также есть и те случаи, в которых требуется хирургическое вмешательство в течение первых недель жизни ребенка.
Когда рождается недоношенный ребенок со сложной врожденной сердечной патологией, очень важно планировать будущую стратегию действий. Семьи обычно в таких случаях психологически шокированы ситуацией, поэтому им требуется помощь профессионалов, которые смогут оказать им поддержку в принятии важных решений.
Хосе Мария Каффарена — глава отделения сердечных патологий и заведующий отделения кардиохирургии Госпиталя Сант Жоан де Деу Барселона, вместе со своей командой проводит сердечно-сосудистые операции для пациентов с врожденными пороками сердца. Когда команда доктора Каффарены сталкивается с одним из таких случаев, он должен принять решение быстро, обычно в первые дни или недели жизни ребенка.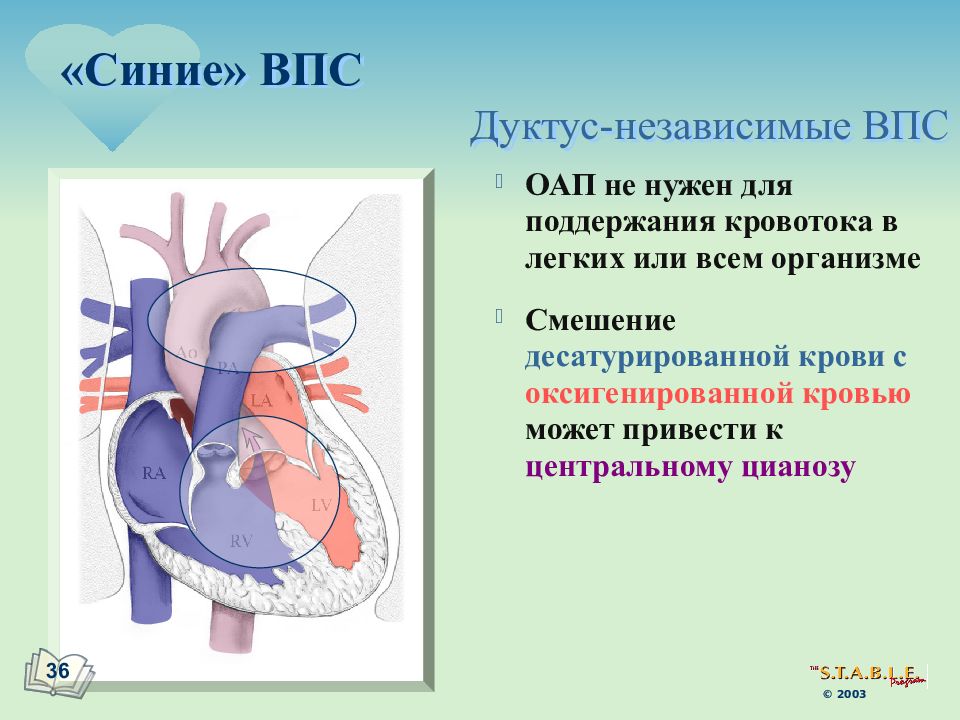
эти первые недели жизни жизненно важны для будущего ребенка
Реализация хирургического вмешательства в такой же степени сложна, как и знание, когда и как управлять сердцем ребенка, родившегося на 32-неделе беременности, с недоразвитием всех жизненно важных органов. Как говорит доктор Каффарена, «эти первые недели жизни жизненно важны для будущего ребенка». В медицинских центрах, которые проводят хирургические операции, должна быть команда высококвалифицированных специалистов и, кроме того, они должны обладать самыми лучшими техническими ресурсами, которые могут облегчить задачу хирургов. Основные осложнения, которые могут возникнуть у данных пациентов, могут повлиять на дыхательную и неврологическую систему. После того, как было принято трудное решение о проведении операции на сердце недоношенному ребенку, запускается процесс проведения хирургического вмешательства, которое заканчивается деликатным послеоперационным периодом. После проведения операции, мы можем встретить пациентов, у которых нет осложнений, пациентов, у которых возникают временные осложнения или,в худшем случае, новорожденных с хроническими осложнениями.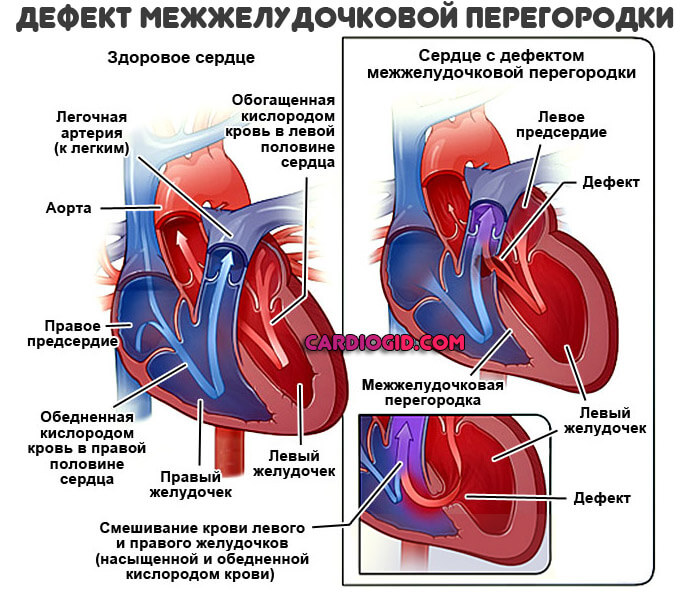
На сегодняшний день Госпиталь Сант Жоан де Деу Барселона имеет нулевой показатель смертности по кардиохирургическим операциям с минимальной тяжестью последствий. Этот факт очень важен, поскольку мы говорим об очень сложных вмешательствах, в которых риски, которые должен предпринять хирург, очень высоки и возможные последствия для пациента могут оказаться очень серьёзными.
В течение апреля 2017 года команда кардиохирургов Госпиталя Сант Жоан де Деу впервые провела операцию на открытом сердце недоношенному ребенку, по исправлению серьезного врожденного порока, который мог бы привести к смерти. У ребенка был порок — транспозиция магистральных сосудов (ТМС), который означает неправильное положение главных сосудов, отходящих от сердца, т.е. аорты и ствола легочной артерии, относительно друг друга и относительно камер сердца, от которых они отходят. Это ситуация, когда сосуды полностью переместились, поменялись своими местами. Аорта отходит от правого желудочка, а легочная артерия — от левого. Эта врожденная аномалия вызывает параллельную циркуляцию крови, которая заставляет кислородсодержащую кровь возвращаться в легкие вместо того, чтобы проходить через аорту, чтобы насытить кислородом органы тела и наоборот. Кровь без оксигенации возвращается в организм, что вызывает недостаток кислорода в тканях. На восьмой день после родов, команда Госпиталя Сант Жоан де Деу Барселона, состоящая из кардиохирургов, кардиологов, неонатологов, реаниматологов, анестезиологов и медсестер, провела четырехчасовую операцию по исправлению порока — транспозиция магистральных сосудов. Эта техника обычно применяется у пациентов с нормальным весом, но в этот раз данная операция была сделана впервые в Испании у глубоко недоношенного ребенка (32 недели беременности) с экстремально низким весом (1370 граммов).
Аорта отходит от правого желудочка, а легочная артерия — от левого. Эта врожденная аномалия вызывает параллельную циркуляцию крови, которая заставляет кислородсодержащую кровь возвращаться в легкие вместо того, чтобы проходить через аорту, чтобы насытить кислородом органы тела и наоборот. Кровь без оксигенации возвращается в организм, что вызывает недостаток кислорода в тканях. На восьмой день после родов, команда Госпиталя Сант Жоан де Деу Барселона, состоящая из кардиохирургов, кардиологов, неонатологов, реаниматологов, анестезиологов и медсестер, провела четырехчасовую операцию по исправлению порока — транспозиция магистральных сосудов. Эта техника обычно применяется у пациентов с нормальным весом, но в этот раз данная операция была сделана впервые в Испании у глубоко недоношенного ребенка (32 недели беременности) с экстремально низким весом (1370 граммов).
Госпиталь Сант Жоан де Деу Барселона является ведущим центром в Испании по лечению пороков сердца.

Медицинская команда, которая выполняет операции на сердце у новорожденных, состоит из медицинских специалистов разных дисциплин, которые должны координировать свои действия, чтобы успешно проводить эти сложнейшие операции. Как отмечает д-р Каффарена:
Операция на сердце у недоношенных детей с низким весом будет успешной, если она будет проведена в узкоспециализированном центре и ее сделают новорожденному ребенку в первые дни после рождения
Неонатальный скрининг врожденных пороков сердца
О проекте
Неонатальный скрининг — один из эффективных способов выявления наиболее распространенных врожденных и наследственных заболеваний у новорожденных детей, позволяющий обеспечить раннее выявление заболеваний и их своевременное лечение, остановить развитие тяжелых проявлений заболеваний, ведущих к инвалидизации.
По социально-медицинской значимости патология сердечно-сосудистой системы занимает второе место среди врожденных пороков развития. В периоде новорожденности существует определенный круг пороков, которые потенциально могут угрожать жизни ребенка. Это так называемые критические пороки, при которых оказание кардиохирургической помощи показано в первые дни, а подчас в первые часы жизни ребенка.
В периоде новорожденности существует определенный круг пороков, которые потенциально могут угрожать жизни ребенка. Это так называемые критические пороки, при которых оказание кардиохирургической помощи показано в первые дни, а подчас в первые часы жизни ребенка.
Учитывая значимость проблемы, в 2012 году по инициативе Президента Ассоциации детских кардиологов России, профессора Школьниковой Марии Александровны, на тот момент — главного детского кардиолога Департамента здравоохранения города Москвы (ДЗМ), под эгидой ДЗМ и при участии членов Ассоциации детских кардиологов России, сотрудников ведущих научных и клинических медицинских учреждений страны: НИКИ педиатрии им. академика Ю.Е. Вельтищева, ГБУЗ «Городская клиничеcкая больница № 67 имени Л.А. Ворохобова ДЗМ», ГБУЗ «Детская клиническая инфекционная больница №6 ДЗМ», ГБУЗ «Детская городская клиническая больница №13 имени Н.Ф. Филатова ДЗМ», ФГБУ «Национальный медико-хирургический Центр имени Н.И. Пирогова» Минздрава России, были разработаны Методические рекомендации «Неонатальный скрининг с целью раннего выявления критических врожденных пороков сердца».
Появление новых научных данных, изменения действующего законодательства, совершенствование требований к проведению скрининговых исследований делают актуальной проблему пересмотра и доработки методических рекомендаций, приведения их в соответствие с реалиями сегодняшнего дня.
Ассоциация детских кардиологов России считает целесообразным на основе данных методических рекомендаций разработать клинические рекомендации по неонатальному скринингу раннего выявления критических врожденных пороков сердца и предложила сформировать рабочую группу проекта со сроком реализации 1 год.
Постгеморрагическая гидроцефалия у младенцев с крайне низкой массой тела при рождении: резервуар Оммайя по сравнению с вентрикулоперитонеальным шунтом
ВЖК остается серьезной проблемой у младенцев с очень низкой массой тела, и у значительной части пораженных младенцев развивается прогрессирующая и симптоматическая гидроцефалия.
Клинические признаки симптоматической ПГГ включают быстрое увеличение орбитофронтальной окружности головы, повышенное растяжение черепных швов, выступающий и напряженный родничок и ухудшение клинического статуса [5].
В случаях преждевременных родов было продемонстрировано, что частота ВЖК может быть снижена путем введения матери кортикостероидов до 34-й недели гестации [8, 9]. ВЖК остается серьезной проблемой, и у 25% пострадавших младенцев развивается дилатация желудочков, которая может разрешиться спонтанно или прогрессировать и требовать дальнейшего лечения [10]. Было показано, что необходимость в хирургическом вмешательстве зависит, прежде всего, от степени тяжести ВЖК.
Как правило, установка шунта у очень недоношенных детей после желудочкового кровотечения связана с повышенным риском шунтирующей недостаточности и инфекции шунта [3, 5].
Вскоре после внутрижелудочкового кровотечения в спинномозговой жидкости в значительных количествах присутствуют продукты разложения крови и мусор. В этих условиях размещение VPS с клапанным механизмом сопряжено с повышенным риском обструкции шунта [3]. Кроме того, у многих из этих очень маленьких младенцев система постоянного шунтирующего клапана плохо переносится, и может произойти разрушение кожи и шунтирующая инфекция. Поэтому мы предпочитаем выполнять первоначальное введение небольших временных подкожных резервуаров для спинномозговой жидкости — подход, который использовался у 18 из 25 младенцев в настоящем исследовании.В крупном многоцентровом исследовании в Северной Америке две трети пациентов изначально лечились резервуаром спинномозговой жидкости, а меньшая фракция подвергалась установке вентрикулосубгалеального шунта или внешнего дренажа [3]. Временное размещение резервуара CSF было предпочтительным начальным лечением PHH в 79% из примерно трех третей немецких нейрохирургических отделений и 70% отделений детской хирургии. Первичное размещение VPS предпочли лишь незначительное меньшинство респондентов [4].
В этих условиях размещение VPS с клапанным механизмом сопряжено с повышенным риском обструкции шунта [3]. Кроме того, у многих из этих очень маленьких младенцев система постоянного шунтирующего клапана плохо переносится, и может произойти разрушение кожи и шунтирующая инфекция. Поэтому мы предпочитаем выполнять первоначальное введение небольших временных подкожных резервуаров для спинномозговой жидкости — подход, который использовался у 18 из 25 младенцев в настоящем исследовании.В крупном многоцентровом исследовании в Северной Америке две трети пациентов изначально лечились резервуаром спинномозговой жидкости, а меньшая фракция подвергалась установке вентрикулосубгалеального шунта или внешнего дренажа [3]. Временное размещение резервуара CSF было предпочтительным начальным лечением PHH в 79% из примерно трех третей немецких нейрохирургических отделений и 70% отделений детской хирургии. Первичное размещение VPS предпочли лишь незначительное меньшинство респондентов [4].
Недавно нейроэндоскопический лаваж и третья вентрикулостомия были оценены для лечения ПГГ [10, 11].
У пациентов с PHH установка VPS связана с повышенным риском осложнений (включая утечку спинномозговой жидкости, инфекцию, непроходимость и разрушение кожи). В нашей серии был зарегистрирован только один случай механической дисфункции и один случай внешнего дренажа для инфекции после перехода на VPS. Это ниже, чем сообщается в недавно опубликованном обзоре, в котором средняя частота шунтирующих инфекций на операцию составляет примерно 8% [2].
Однако в предыдущей серии только у 1 из 20 (5%) детей с ОНМТ инфекция СМЖ развилась после 71 процедуры постукивания на каждого пациента [12].
Низкий уровень механических осложнений в настоящем исследовании можно объяснить ретроспективным характером этого исследования. Небольшие подкожные скопления спинномозговой жидкости без нарушения функции резервуара не имели большого клинического значения и могли остаться незамеченными. Согласно литературным данным, частота осложнений с резервуаром может достигать 22% [3].
В нашем исследовании 15 из 17 (88%) пациентов подверглись конверсии на постоянный шунт (в том числе 1 пациент был потерян для последующего наблюдения).У 2 из наших пациентов симптоматическая гидроцефалия исчезла, и попытки установки VPS не предпринимались. Наш коэффициент конверсии сравним с результатом другой серии учреждений, у которых коэффициент конверсии в постоянное шунтирование составил 85% [12]. Однако наш коэффициент конверсии в постоянный шунт был выше, чем в недавнем большом многоцентровом исследовании, в котором конверсия в VPS произошла у 69% младенцев [3]. Эти различия можно объяснить выбором пациентов и критериями лечения, которые варьируются в зависимости от хирурга и учреждения.Так, в других исследованиях сообщалось о переходе на постоянный шунт у 100% младенцев [3]. В метаанализе независимость от шунта была достигнута у 3,2–9% младенцев [2].
Подавляющее большинство младенцев в нашей серии имели очень или очень низкий вес при рождении. Очень незрелые новорожденные предрасположены к высокому уровню сопутствующих заболеваний и клинических проблем. У некоторых наших пациентов UApH был ниже 7,11. Это согласуется с результатами недавнего метаанализа, в котором низкий уровень UApH был связан с повышенным риском церебральной заболеваемости (т.е., ВЖК и перивентрикулярная лейкомаляция). Предполагается четкая доза-реакция между pH и заболеваемостью, причем наиболее сильная связь наблюдается при пороге pH 7,00 [13].
Тяжелая неонатальная септицемия, одна из основных причин ВЖК, была обнаружена у двух пациентов нашей когорты [8]. В нашем исследовании мы обнаружили высокий уровень торакальных и абдоминальных явлений / инфекций, и у значительного числа пациентов потребовалось лечение КПК. Согласно литературным данным, профилактическое внутривенное введение индометацина, которое используется для лечения многих детей с ЭНМТ, не влияет на риск ВЖК.Однако постоянное кровообращение плода способствует гиперкапнии и ацидозу с повышенным риском ВЖК и последующей гидроцефалии [5].
Все пациенты в нашей серии были доставлены путем кесарева сечения (КС), и более одной трети младенцев были близнецами или тройняшками. Считается, что КС снижает риск ВЖК [5]. Большинство пострадавших от множественных новорожденных детей в нашей серии были первенцами. Гипотеза о невыгодном положении новорожденных близнецов не может быть подтверждена литературой [14].Согласно недавно опубликованным исследованиям, способ родоразрешения и многоплодная беременность не были связаны с повышенным риском тяжелого ВЖК [8, 14]. Более того, результат первого родившегося близнеца, похоже, аналогичен исходу второго родившего близнеца. Однофакторный анализ показал, что ранний сепсис и возникновение пневмоторакса являются основными причинами ВЖК у детей с ЭНМТ [8]. Другие материнские факторы (например, курение или социально-экономический статус) не были связаны с более высокой частотой ВЖК [8].
В нашу серию вошли 25 детей старше 8,5 лет, что дает среднегодовую частоту трех случаев. Согласно недавно опубликованному исследованию, отделения нейрохирургии и детской хирургии сообщали о количестве случаев от 1 до 20 случаев в год (в среднем от 7 до 9) [4]. Кроме того, было показано, что объем хирурга и больницы сильно влияют на исход лечения [15]. Таким образом, все операции проводились выборочно двумя опытными специализированными детскими хирургами большого объема или под наблюдением этих хирургов.
В заключение, мы продемонстрировали, что ПГГ развивается более остро с более низким гестационным возрастом у очень недоношенных детей. Подавляющему большинству этих младенцев требуется перевод с временной вентрикулостомии на постоянную VPS. Однако в подгруппе младенцев прогрессирующая ПГГ развивается позже, и можно рассмотреть возможность введения первичного ВПС.
Процедура вентрикулосубгалеального шунтирования и ее отдаленные результаты у недоношенных детей с постгеморрагической гидроцефалией
Несмотря на то, что VSGS не может обеспечить адекватный дренаж спинномозговой жидкости даже в недоношенных случаях с низкой массой тела при рождении, при толщине коры головного мозга ниже 1 см наряду с большими желудочками на ультразвуковом изображении, вентрикулоперитонеальный шунт (VPS) не был предпочтительнее VSGS из-за следующих предпосылок, необходимых для процедуры VPS: наличие зрелой иммунной системы и адекватная абсорбционная способность брюшной полости, эффективное удаление крови продукты от ЦСЖ поступают в желудочковую систему и достаточную толщину подкожной клетчатки.Во время улучшения этих параметров наиболее важным параметром, за которым можно следить, является масса тела. Таким образом, принято считать, что перед процедурой следует подождать, пока масса тела превысит 2000 г. [2, 4]. В этот период необходим постоянный раствор с минимальным потенциалом повреждения, чтобы защитить ослабленную паренхиму головного мозга от воздействия повышенного внутричерепного давления и предотвратить возможные осложнения.
Известно, что повторные пункции желудочков и поясничных пункций у недоношенных новорожденных могут увеличить риск менингита.Точно так же наружные дренажные системы желудочков подвергают внутрижелудочковую среду внешнему воздействию, и впоследствии пациенты со слабой иммунной системой подвергаются риску инфицирования. Более того, они могут привести к проблемам с перетяжкой. Сообщается даже, что эти три метода могут вызвать метаболические нарушения, связанные с потерей спинномозговой жидкости, белка и электролитов.
Более того, система подкожного желудочкового резервуара оказалась неподходящим методом для недоношенных детей без подкожной клетчатки.Из-за многократных проколов резервуара с целью аспирации кожный покров резервуара может быть легко поврежден. Сообщается, что он часто осложняется инфекцией и некрозом кожи [5, 6].
Время применения VSGS у недоношенных детей с гидроцефалией является спорным вопросом в литературе, и только два исследования высказывают четкие мнения. Willis et al. сообщают, что эта продолжительность составляет 30 дней (4,2 недели), тогда как Fulmer et al. выразите это как 28 дней (4 недели). В настоящем исследовании VSGS выполнялась в среднем через 35 лет.Через 4 дня после рождения. Среднее значение было повышено из-за плохих показателей жизнедеятельности некоторых пациентов и ухода за ними с помощью аппарата ИВЛ.
Сообщается, что выполнение VPS в раннем периоде при преждевременных случаях ПГГ связано с повышенной частотой инфицирования шунта наряду с высокой частотой обструкции шунта [7]. Тейлор и др. опубликовали серию из 36 случаев в 2001 году и высказались за то, что VPS следует проводить у недоношенных детей на поздних сроках из-за необходимости очищения желудочка от продуктов крови, что занимает не менее 5 недель.Поскольку VPS применялся в среднем по прошествии 42 дней в их случаях, и в девяти (25%) из 36 случаев наблюдалась обструкция шунта, им пришлось применить 21 пересмотр [8]. В течение этих 42 дней они не выполняли никаких процедур, чтобы защитить белое вещество вокруг желудочка от повышения внутричерепного давления. Однако у недоношенных детей 4 степени могут наблюдаться резкие изменения клинического состояния, а гидроцефалия может развиваться очень быстро [7, 9]. В этих условиях рекомендуется ранняя процедура VPS [2, 3, 7, 8].Авторы предлагают не применять VPS до тех пор, пока вес ребенка не достигнет 2000 г, а уровень спинномозговой жидкости не упадет ниже 1000 мг / дл [3, 8].
Аналогичным образом Levy et al. выполнили VPS при лечении преждевременных случаев ПГГ и сообщили о 83% обструкции шунта, тогда как Lin JP et al., McCallum et al. и Scarff et al. отметили, что частота обструкции шунта составляет 89, 94 и 50% соответственно [11–15]. В настоящем исследовании 24% наших случаев продемонстрировали обструкцию проксимального конца VPS после процедуры, и эти катетеры были заменены.Наблюдается меньшая частота осложнений, связанных с обструкцией вентрикулоперитонеального шунта при лечении ПГГ, поскольку оно проводится после ВСГС.
В литературе, когда VSGS терпит неудачу в лечении гидроцефалии среди преждевременных случаев с LBW и PHH, практика VPS описывается для пациентов, которые, как считается, достигли адекватной зрелости [5, 9, 10, 16]. Таббс и др. [17] сообщили о продолжительности пребывания в VPS или VSGS в 37,4 дня, тогда как Fulmer et al. рекомендовали, чтобы эта продолжительность составляла не менее 1 месяца у новорожденных с ВЖК из-за необходимости очистки внутрижелудочкового мусора [16, 17].В настоящем исследовании VPS выполняли в среднем через 44 дня. Судя по литературным данным, это может показаться поздним, однако мы ждали, когда наши случаи достигнут веса тела 2000 г.
В литературе осложнениями, наблюдаемыми при мониторинге случаев с VSGS, являются утечка спинномозговой жидкости из места разреза, менингит, миграция катетера из желудочка или его проскальзывание в желудочек и внутрипаренхиматозное кровоизлияние [5, 9]. Сообщается, что скорость утечки спинномозговой жидкости из места разреза составляет 16.6% по Уиллису и др. [9], 4,7% по Таббсу и др. [17], 5% — Fulmer et al. [5] и 32% Склар и др. [18]. В настоящем исследовании скорость утечки спинномозговой жидкости из места разреза составила 29% (семь случаев), что находится в пределах верхнего предела среднего значения результатов, приведенных в литературе. Мы считаем, что если уделять больше внимания технике хирургического закрытия, это осложнение можно уменьшить.
По данным Willis et al., Частота инфекционных осложнений, связанных с VSGS, составляет 66,7%.[9], 5,9% по Таббсу и др. [17], 0% — Fulmer et al. [5] и 10% по Sklar et al. [18]. Рахман и др. [19] сообщили об отсутствии развития инфекции после проведения процедур VSGS и VPS у 15 недоношенных детей с PHH и массой тела при рождении менее 1500 г. Более того, в отсутствие лечения VSGS частота инфицирования после раннего лечения VPS у недоношенных детей с PHH, как было обнаружено Vinchon et al., Увеличивалась с 20 до 50%. [20] и 45,2% по Reinprecht et al. [2]. В литературе сообщается, что частота заражения другими методами, используемыми в лечении ПГГ, составляет 15.9–16,4 [21] при методе подкожного резервуара и 10–27% при методе EVD [22]. Ричард и др. [23], установили резервуар Оммайя в 64 случаях и сообщили об осложнениях (легочные проблемы, менингит, сепсис и кровоизлияние) в 30 из них, при этом отметили общий уровень инфицирования 21,8%. В настоящем исследовании уровень инфицирования составил 8%, что согласуется с литературными данными по VSGS. Более того, наш результат оказался значительно ниже, чем частота инфицирования другими методами лечения, описанными в литературе [20–24].
Другие осложнения в литературе упоминаются редко. Частота развития нового внутрипаренхиматозного кровоизлияния составила 1,1% (два случая) Tubbs et al. и 5% (один случай) Fulmer et al. [5].
Кроме того, отмечалось, что смертность, связанная с шунтированием, является результатом кровотечения из-за разрыва хрупких кортикоменингеальных артерий и вен из-за быстрой интраоперационной декомпрессии в слабомиелинизированном мозге новорожденного под давлением [5].Однако Fulmer et al. [5] и Таббс и др. [17] в своих исследованиях отметили мультифокальное происхождение внутримозгового кровоизлияния. Хотя Фулмер и др. не использовали клапан в своих процедурах VSGS, Tubbs et al. [17] использовали дистальный щелевой клапан, который обеспечивает односторонний поток спинномозговой жидкости в субгалеальный мешок, и предположили, что с этим может быть связано внутрипаренхиматозное кровоизлияние. Новорожденные, перенесшие ВПС, могут иметь это редкое осложнение в результате острой желудочковой декомпрессии [5, 17]. Более того, Ричард и др.предоставили фибринолитическое лечение 17 пациентам в своем исследовании и сообщили о четырех случаях смерти из-за диффузного смертельного кровотечения [23]. В данной серии после процедуры VSGS не наблюдалось осложнений внутрипаренхиматозного кровоизлияния, поскольку в использованные катетеры не был вставлен клапан, и рана была закрыта до того, как позволил чрезмерный дренаж спинномозговой жидкости. Более того, в одном из наших случаев было продемонстрировано субдуральное кровоизлияние в мозг, которое наблюдалось через 15 дней после VSGS (рис. 8). Перед введением желудочкового катетера из-за недостаточного прижигания твердой мозговой оболочки, через которую он пройдет, и постепенного венозного кровотечения у новорожденного с низким внутричерепным давлением, рассматривалось образование хронической субдуральной гематомы.В литературе такое осложнение не описано.
Рис.8Субдуральное кровоизлияние, осложнение
Проскальзывание катетера в желудочек или его миграция из желудочка сообщалось только Fulmer et al. [5] в одном (5%) случае. В текущем исследовании аналогично, в одном (4%) случае катетер соскользнул в желудочек, в то время как в другом случае весь катетер переместился в подгареальное пространство. Fulmer et al.[5] удалили катетер, который входил в желудочек, и выполнили процедуру VPS. В нашем случае катетер был удален под эндоскопическим контролем, и, учитывая остановку гидроцефалии, не было обнаружено необходимости в другом шунтирующем вмешательстве (рис. 9). Мы провели VPS в другом случае, когда катетер был перенесен в подгареальное пространство.
Рис. 9Желудочковый катетер при падении и остановке, случай гидроцефалии
В литературе Willis et al. Сообщают, что уровень смертности для случаев VSGS составляет 16%.[9], 9% по Таббсу и др. [17], 12% — Склар и др. [18] и 20% — Fulmer et al. [5]. Однако подробная информация о причинах этих смертей отсутствует. В настоящем исследовании уровень смертности оказался выше. Причиной этого может быть тот факт, что случаи 3 и 4 степени составляли большинство случаев в нашем исследовании. Linder et al. [25] провели исследование, в котором участвовал 641 случай, и потеряли 86 (13,4%) недоношенных новорожденных с низкой массой тела, в то время как в 36 случаях в их исследовании была ВЖК 3 и 4 степени, а у 27 (75%) из них наблюдалась смертность.Кадри и др. выполнили исследование, в котором они потеряли 86% случаев с ГМЗ 3 степени и 100% случаев с ГМЗ 4 степени [7].
Ревизия VSGS была выполнена в 52 (28%) из 185 случаев Tubbs et al. [17] и в 5 (25%) из 20 случаев Fulmer et al. [5]. В обеих сериях единственной причиной ревизии было развитие спаек в подгалеальном кармане, однако обструкции внутрижелудочкового катетера не было. Сообщается, что в частности, эти шрамы от спаек возникают из-за инфицированного мусора [5, 17, 21].Сообщается, что при ревизионной хирургии в случаях, когда катетер не закупорен, достаточно простого рассечения субгалеального мешка [17]. В нашей серии ревизия была применена в трех случаях против подаглеальных спаек. Эти результаты согласуются с данными в литературе.
С точки зрения отсутствия необходимости в постоянном VPS, в то время как Willis et al. [9] сообщили о показателе 16,6% (один случай), Fulmer et al. [5], Sklar et al. [18] и Rahman et al. [19] отметили уровень 20% (четыре случая), 11% (семь случаев) и 20% (три случая), соответственно.В текущем исследовании частота случаев, требующих VPS, составила 12% (три случая). Наш результат соответствовал литературным данным.
Сообщается, что постоянный VPS необходим для лечения PHH, обычно наблюдаемого у недоношенных детей, частота которого колеблется от 60 до 85% [24, 26–30]. Хотя Willis et al. [9] обнаружили, что этот показатель составляет 83,4%, Tubbs et al. [17], Fulmer et al. [5], Sklar et al. [18] и Rahman et al. [19] сообщили, что она составила 84, 75, 90 и 75% соответственно. Более того, шунтирующая зависимость, возникающая после других методов лечения PHH, составляет 64–78% после БВВЭ и 75–88% после использования подкожного резервуара [21, 22, 31, 32].В текущем исследовании было обнаружено, что потребность в шунте составляет 60%. Низкий уровень потребности в шунте объясняется тем, что в некоторых случаях VSGS не нуждался в VPS во время периода мониторинга.
Мониторинг случаев ПГГ после ВПС, по сообщениям Fulmer et al., Продемонстрировал 33% осложнений, связанных с инфекцией шунта. [5]. В нашем исследовании частота инфицирования шунта составила 24%. Linder et al. [25] сообщили о 75% смертности среди случаев ГМЗ 3 и 4 степени. Кадри и др. [7] отметили распределение показателей смертности по классам GMH следующим образом: 38% для 1-й степени, 66% для 2-й степени, 86% для 3-й степени и 100% для 4-й степени.В текущем исследовании, в то время как уровень смертности среди случаев 2 степени составлял 0%, он составлял 38,5% для случаев 3 степени и 50% для случаев 4 степени. Эти результаты не соответствовали литературным данным. Причина этого несоответствия — неадекватность ежедневного временного дренажа спинномозговой жидкости, применяемого через LP до процедуры VPS против гидроцефалии в исследовании Kadir et al. наряду с вкладом VSGS в прогнозы наших случаев. В следующих контрольных группах мы потеряли все наши случаи 4 степени в соответствии с литературой, тогда как прогноз для наших случаев с ГМЗ 4 степени был плохим.
Как правило, в литературе сообщается, что выживаемость случаев ГМГ и ВЖК составляет 25–75% [33–35]. Казань и др. [3] сообщили о смертности от ВЖК, связанной с ГМГ, у недоношенных новорожденных, с хирургическим вмешательством или без него, как 38%. Кадри и др. [7] наблюдали за 126 случаями и сообщили о 70 (55,5%) потерях. В текущем исследовании, когда период после VPS также был включен в мониторинг, 52% (13 случаев) были потеряны во время мониторинга, что соответствовало литературным данным.Все результаты сравнивались с литературными данными в таблице 1.
Таблица 1 Обобщение результатов другой литературы и нашего исследованияРезервуар Оммайя по сравнению с вентрикулоперитонеальным шунтом
Это ниже, чем сообщается в недавно опубликованном обзоре, в
, где средняя частота шунтирующей инфекции на операцию составляла
, как было обнаружено, примерно 8% [2].
Однако в предыдущей серии только у 1 из 20 (5%) детей с VLBW
инфекция СМЖ развилась после 71 постукивания
процедур на пациента [12].
Низкий уровень механических осложнений в настоящем исследовании
можно объяснить ретроспективным характером этого исследования. Небольшие подкожные скопления спинномозговой жидкости без нарушения функции резервуара
не имели большого клинического значения
и, возможно, остались необнаруженными. Согласно литературным данным, частота осложнений
коллектора может достигать 22% [3].
В нашем исследовании 15 из 17 (88%) пациентов подверглись конверсии
в постоянный шунт (в том числе 1 пациент был потерян из-за
низкого уровня).У 2 из наших пациентов симптоматическая гидроцефалия повторно исчезла, и попытки установки VPS не предпринимались. Скорость нашей версии
сравнима с результатом другой отдельной серии
, которая имела коэффициент преобразования 85% в постоянный шунт
[12]. Однако наш коэффициент конверсии в постоянный шунт
был выше, чем в недавнем большом многоцентровом исследовании
, в котором преобразование в VPS произошло у 69% младенцев
[3].Эти различия можно объяснить выбором пациентов и критериями лечения
–, которые различаются в зависимости от хирурга и учреждения.
Таким образом, в других исследованиях сообщалось о конверсии в постоянный шунт
у 100% младенцев [3]. Согласно метаанализу, независимость от шунта
ибыла достигнута у 3,2–9% младенцев [2].
Подавляющее большинство младенцев в нашей серии имели очень или очень низкий вес при рождении. Очень незрелые новорожденные
предрасположены к высокому уровню сопутствующих заболеваний и клинических проблем
лем.У некоторых из наших пациентов UApH был ниже 7,1-1. Это
, что согласуется с результатами недавнего метаанализа, в котором
низкий UApH был связан с повышенным риском церебральной заболеваемости
(т.е. перивентрикулярная лейкомаляция). Предполагается четкая связь
доза-реакция между pH и заболеваемостью,
с самой сильной ассоциацией при пороге pH 7,00 [13].
Тяжелая неонатальная септицемия, одна из основных причин ВЖК,
была обнаружена у двух пациентов нашей когорты [8].В нашем исследовании
мы обнаружили высокий уровень торакальных и абдоминальных событий / инфекций, и лечение КПК потребовалось у значительного числа
пациентов. Согласно литературным данным, профилактическое внутривенное введение индометацина
ноус, которое используется для лечения многих детей с ЭНМТ,
не влияет на риск ВЖК. Однако постоянное кровообращение плода способствует гиперкапнии и ацидозу с повышенным риском ВЖК и последующей гидроцефалии [5].
Все пациенты в нашей серии были доставлены посредством кесарева сечения
(CS), и более одной трети младенцев были близнецами или
тройняшками. Считается, что КС снижает риск ВЖК [5].
большинства пострадавших от множественных новорожденных в нашей серии были первенцами
. Гипотеза о невыгодном положении новорожденных близнецов
не может быть подтверждена литературой
[14]. Согласно недавно опубликованным исследованиям, способ родов
и многоплодная беременность не были связаны с повышенным на
риском тяжелой ВЖК [8, 14].Более того, результат
для первого представленного близнеца, похоже, аналогичен результату
для второго доставленного близнеца. Однофакторный анализ показал, что
раннего сепсиса и возникновение пневмоторакса являются основными причинами
ВЖК у детей с ELBW [8]. Другие материнские факторы
(например, курение или социально-экономический статус) не были связаны
с более высокой частотой ВЖК [8].
В нашу серию вошли 25 детей старше 8 лет.5 лет, что дает среднегодовую частоту
случаев из трех. Согласно недавно опубликованному опросу
, нейрохирургия и детская хирургия
единиц сообщили о количестве случаев от 1 до 20 случаев в год
(медиана от 7 до 9) [4]. Кроме того, было показано, что количество хирургов и больниц
сильно влияет на амбулаторное лечение
пациентов [15]. Таким образом, все операции выполнялись выборочно
двумя опытными и специализированными педиатрическими хирургами большого объема
геонов или под наблюдением этих хирургов.
В заключение, мы продемонстрировали, что ПГГ на
развивается более остро с более низким гестационным возрастом у
очень недоношенных детей. Подавляющему большинству этих младенцев требуется преобразование
из временной вентрикулостомии в постоянную VPS. Тем не менее, в подгруппе младенцев прогрессивный PHH развивается позже, и можно рассматривать введение
первичных VPS.
Благодарности Авторы благодарны всем родителям и неоновым
тологам, оказавшим доверие коллективу отделения детской хирургии
.Большое спасибо всем детским хирургам,
реаниматологов новорожденных, анестезиологам и медсестрам, которые работали с
этих детей с первых дней их жизни.
Соблюдение этических норм Авторы заявляют, что у них нет
конкурирующих интересов.
Совет по этике исследований Рурского университета Бохума ap-
подтвердил это исследование.
Открытый доступ Эта статья распространяется на условиях Creative
Commons Attribution 4.0 Международная лицензия (http: //
creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование,
распространение и воспроизведение на любом носителе, при условии, что вы предоставите
права на имя оригинального автора. (s) и источник, дайте ссылку на лицензию
Creative Commons и укажите, были ли внесены изменения.
Список литературы
1. Schleußer E (2013) Профилактика, диагностика и лечение преждевременных родов
. Dtsch Arztebl Int 110: 227–236.DOI: 10.3238 /
arztebl.2013.0227
2. Винчон М., Рекате Х., Кулькарни А.В. (2012) Педиатрическая гидроцефа —
исходов: обзор. Барьеры для жидкостей CNS 9:18
3. Wellons JC III, Sh anno n CN, Kulkarni AV, Simon TD, Riva-
Cambrin J, Whitehead WE, Oakes WJ, Drake JM, Luerssen TG,
Walker ML, Kestle JRW (2009) Многоцентровое ретроспективное сравнение
преобразование из временного в постоянный спинномозговой
Отвод жидкости у младенцев с очень низкой массой тела при рождении с постгеморозной
рагической гидроцефалией.J Neurosurg Pediatr 24: 50–55. DOI: 10.
3171 / 2009.2.PEDS08400
4. Mauer UM, Unterreithmeir L, Jahn A, Wagner W, Kunz U, Schulz
C (2013) Обзор современной практики нейрохирургии —
Возраст недоношенных детей постгеморрагическая гидроцефалия
Германия. J Neurol Surg A Cent Eur Neurosurg 74: 82–86
Childs Nerv Syst (2015) 31: 1261–1266 1265
Осложнения желудочно-перитонеального шунта: обзор
Основные моменты
- •
Обструкция является наиболее частой причиной нарушения работы вентрикулоперитонеального шунта (ВПШ).
- •
Инфекция — вторая по частоте причина неисправности VPS, которая чаще встречается у детей.
- •
Псевдокиста — это позднее осложнение VPS, которое может проявляться болью в животе и пальпируемым образованием.
- •
Перфорация кишечника — редкое осложнение ВПС, которое в основном возникает у недоношенных и новорожденных.
- •
Образование субдуральной гематомы может происходить при избыточном шунтировании в случаях гидроцефалии низкого давления.
Abstract
Установка вентрикулоперитонеального шунта (VPS) является одной из наиболее часто выполняемых нейрохирургических процедур и необходима для лечения большинства форм гидроцефалии. К сожалению, осложнения, связанные с установкой VPS, являются обычным явлением, и на протяжении всей жизни пациента почти ожидаются многократные ревизии шунта. Нарушение работы шунта может быть связано с множеством причин, включая непроходимость, инфекцию, образование псевдокист и перфорацию кишечника. Обструкция VPS, которая чаще всего возникает в проксимальном катетере, является наиболее частой причиной неисправности VPS.Инфекция оборудования является второй по частоте причиной неисправности VPS, и это осложнение чаще всего наблюдается у младенцев, причем недоношенные младенцы наиболее восприимчивы. Несмотря на постоянные попытки снизить частоту осложнений VPS, такие как усовершенствованные методы стерилизации, пропитанные антибиотиками катетеры и программируемые клапаны, неисправность VPS остается серьезной проблемой, которая часто приводит к многочисленным и дорогостоящим госпитализациям. В настоящем обзоре обсуждаются наиболее частые осложнения VPS, включая их проявление и соответствующее лечение.
Ключевые слова
Вентрикулоперитонеальный шунт
Инфекция вентрикулоперитонеального шунта
Неисправность вентрикулоперитонеального шунта
Осложнения вентрикулоперитонеального шунта
Вентрикулоперитонеальный шунт Опубликованные статьи
0008 Рекомендованные статьи
000
Elite статей EliteПовторные пункции поясницы или желудочка у новорожденных с внутрижелудочковым кровотечением
Вопрос для повторения
Кокрановские исследователи рассмотрели доказательства влияния удаления спинномозговой жидкости (CSF) с помощью люмбальной или желудочковой пункции и дренирования CSF через иглу, введенную в основание позвоночника или в заполненную жидкостью полость в головном мозге, на повышение показателей инвалидности. , смерть и необходимость постоянного хирургического вмешательства у недоношенных детей, у которых было кровотечение внутри полостей головного мозга (внутрижелудочковое кровотечение (ВЖК)).
Фон
Недоношенные дети подвержены риску развития ВЖК. ВЖК может вызвать накопление в головном мозге избытка спинномозговой жидкости. Риск этого может быть снижен за счет удаления крови из спинномозговой жидкости через поясничную или желудочковую пункцию. Это может снизить потребность в постоянной хирургической процедуре, называемой вентрикулоперитонеальным шунтом (VPS). VPS является проблематичным, поскольку он может легко заразиться, и его часто приходится заменять или ремонтировать, что требует операции.
Характеристики исследования
Мы провели поиск испытаний, проведенных до 24 марта 2016 г., в которых сравнивали удаление спинномозговой жидкости через поясничную или желудочковую пункцию у всех детей с риском развития скопления жидкости в головном мозге с консервативным подходом, при котором это проводилось только при наличии доказательств того, что скопление жидкости вызывало повышенное давление в мозгу. Мы включили четыре испытания, в которых участвовали в общей сложности 280 недоношенных новорожденных, получавших лечение в отделениях интенсивной терапии новорожденных в Великобритании.Испытания были опубликованы между 1980 и 1990 годами.
Ключевые результаты
Мы не нашли доказательств того, что удаление спинномозговой жидкости с помощью поясничной или желудочковой пункции снижает потребность в установке постоянного шунта. Также не было доказательств того, что он снижает риск серьезной инвалидности, множественной инвалидности или смерти. Не было достаточных доказательств, чтобы определить, может ли этот подход привести к повышенному риску развития инфекции в спинномозговой жидкости.
Качество доказательств
Мы оценили исходы тяжелой инвалидности, множественной инвалидности и инвалидности или смерти как доказательства высокого качества.
Мы записали качество доказательств для исходов установки шунта и смерти или установки шунта как доказательства низкого качества, так как в одном включенном исследовании, в котором сообщалось об этом исходе, была проблема с методом случайного распределения.
Что касается исходов до операции: смерти и инфицирования спинномозговой жидкости, качество доказательств было умеренным из-за ранее упомянутой проблемы с распределением. Кроме того, в этих исследованиях не было достаточного количества пациентов, чтобы в достаточной степени ответить на вопрос.В случае инфицирования исхода перед операцией CSF результаты были несовместимы между включенными испытаниями.
Изменения объема желудочков после успешного шунтирования у младенцев с гидроцефалией | Египетский журнал нейрохирургии
Деван М.С., Раттани А., Мекари Р., Гланц Л.Дж., Юнуса И., Батикулон Р.Э., Фигген Дж., Веллонс Дж. К., Парк КБ, Варф Британская Колумбия. Глобальная эпидемиология и заболеваемость гидроцефалией: систематический обзор и метаанализ. J Neurosurg. 2018: 1–15. https://doi.org/10.3171/2017.10.JNS17439.
Энчев Ю., Ой С. Исторические тенденции нейроэндоскопических хирургических методов лечения гидроцефалии. Neurosurg Rev.2008; 31: 249–62. https://doi.org/10.1007/s10143-008-0131-y.
Артикул PubMed Google Scholar
Ауэр Л.М., Хольцер П., Ашер П.В., Хеппнер Ф. Эндоскопическая нейрохирургия. Acta Neurochir (Вена). 1988; 90: 1–14.
CAS Статья Google Scholar
Фарин А., Ариан Х.Э., Озгур Б.М., Парса А.Т., Леви М.Л. Эндоскопическая третья вентрикулостомия. J Clin Neurosci. 2006; 13: 763–70. https://doi.org/10.1016/j.jocn.2005.11.029.
Артикул PubMed Google Scholar
Fritsch MJ, Kienke S, Manwaring KH, Mehdorn HM. Эндоскопическая акведуктопластика и интервентрикулостомия в лечении изолированного четвертого желудочка у детей. Нейрохирургия. 2004; 55: 372–7; обсуждение 7-9.
Артикул Google Scholar
Олбрайт А.Л., Поллак И.Ф., Адельсон П.Д., Солот Дж. Дж. Данные и анализ результатов в детской нейрохирургии. Нейрохирургия. 1999; 45: 101–6.
CAS PubMed Google Scholar
Вирхаммар Дж., Варнтьес М., Лорелл К., Ларссон Э.М. Количественная МРТ для быстрого и независимого от пользователя мониторинга внутричерепного объема спинномозговой жидкости при гидроцефалии. AJNR Am J Neuroradiol. 2016; 37: 797–801. https://doi.org/10.3174/ajnr.A4627.
CAS Статья PubMed Google Scholar
Вивас-Буитраго Т., Пинилья-Монсальве Дж., Джусуэ-Торрес И., Оиши К., Робисон Дж., Кроуфорд Дж. А., Плетников М., Сюй Дж., Баледент О., Локоссу А., Хунг А. Л., Блиц А. М., Лу Дж. И др. Динамика объема желудочков при развитии хронической коммуникативной гидроцефалии у взрослых на модели грызунов. World Neurosurg. 2018; 120: e1120 – e7. https://doi.org/10.1016/j.wneu.2018.08.241.
Артикул PubMed Google Scholar
Rubin RC, Hochwald G, Tiell M, Liwnicz B, Epstein F.Восстановление коркового слоя головного мозга при шунтирующей гидроцефалии. Dev Med Child Neurol Suppl. 1975: 151–6.
Билгинер Б., Огуз К.К., Акалан Н. Эндоскопическая третья вентрикулостомия по поводу нарушения функции у ранее шунтированных младенцев. Childs Nerv Syst. 2009. 25: 683–8. https://doi.org/10.1007/s00381-008-0779-1.
Артикул PubMed Google Scholar
Haubrich C, Czosnyka M, Diehl R, Smielewski P, Czosnyka Z.Объемная нагрузка желудочков показывает механоупругое влияние сообщающейся гидроцефалии на динамическую ауторегуляцию головного мозга. PLoS One. 2016; 11: e0158506. https://doi.org/10.1371/journal.pone.0158506.
CAS Статья PubMed PubMed Central Google Scholar
Ондер Х., Ханалиоглу С. Влияет ли объем удаленной спинномозговой жидкости на реакцию на постукивание при гидроцефалии нормального давления? AJNR Am J Neuroradiol. 2018; 39: E5–6.https://doi.org/10.3174/ajnr.A5422.
CAS Статья PubMed Google Scholar
Тан К., Мейри А., Моури В.Б., Эбботт Р., Гудрич Дж. Т., Сандлер А.Л., Сури А.К., Липтон М.Л., Вагшул М.Э. Визуализация тензора диффузии и количественная оценка объема желудочков у пациентов с хронической гидроцефалией, леченной шунтированием: исследование случай-контроль. J Neurosurg. 2018; 129: 1611–22. https://doi.org/10.3171/2017.6.JNS162784.
Артикул PubMed Google Scholar
Singer OC, Melber J, Hattingen E, Jurcoane A, Keil F, Neumann-Haefelin T, Klein JC. Объемные изменения МРТ после диагностического удаления спинномозговой жидкости при гидроцефалии нормального давления. J Neurol. 2012; 259: 2440–6. https://doi.org/10.1007/s00415-012-6525-3.
Артикул PubMed Google Scholar
Xenos C, Sgouros S, Natarajan K. Изменение объема желудочков в детстве. J Neurosurg. 2002; 97: 584–90. https://doi.org/10.3171/jns.2002.97.3.0584.
Артикул PubMed Google Scholar
Azab WA, Mijalcic RM, Nakhi SB, Mohammad MH. Объем желудочков и нейрокогнитивные исходы после эндоскопической третьей вентрикулостомии: шунтирование — лучший вариант? Обзор. Childs Nerv Syst. 2016; 32: 775–80. https://doi.org/10.1007/s00381-016-3032-3.
Артикул PubMed Google Scholar
Ди Рокко Ф., Гревент Д., Дрейк Дж. М., Боддерт Н., Пьюджет С., Ружо Т., Блаубломм Т., Зера М., Брюнель Ф., Сент-Роуз К.Изменения внутричерепного распределения спинномозговой жидкости после ЭТВ. Childs Nerv Syst. 2012; 28: 997–1002. https://doi.org/10.1007/s00381-012-1752-6.
Артикул PubMed Google Scholar
Xenos C, Sgouros S, Natarajan K, Walsh AR, Hockley A. Влияние типа шунта на изменения объема желудочков у детей с гидроцефалией. J Neurosurg. 2003. 98: 277–83. https://doi.org/10.3171/jns.2003.98.2.0277.
Артикул PubMed Google Scholar
Басаури Л., Корнехо Дж., Варгас Ф. Лечение врожденной и приобретенной гидроцефалии с помощью желудочковой шунтирующей системы. Нейроциругия. 1968; 26: 34–41.
CAS PubMed Google Scholar
Кислер Дж., Рикер Р. Аномальный родничок. Я семейный врач. 2003. 67: 2547–52.
PubMed Google Scholar
Томпсон М.Г., Айзенберг Х.М., Левин Х.С. Младенцы с гидроцефалией: оценка развития и компьютерная томография.Чайлдс Мозг. 1982; 9: 400–10.
CAS PubMed Google Scholar
О’Хейон BB, Дрейк Дж. М., Осип М.Г., Тули С., Кларк М. Соотношение лобных и затылочных рогов: линейная оценка размера желудочков для нескольких методов визуализации при детской гидроцефалии. Педиатр Нейрохирург. 1998. 29: 245–9. https://doi.org/10.1159/000028730.
CAS Статья PubMed Google Scholar
Факторы риска, связанные с постгеморрагической гидроцефалией у младенцев с очень низкой массой тела при рождении на сроке 24–28 недель
Среди детей с очень низкой массой тела в сроке от 24 до 28 недель гестации со степенью 2 и выше PIVH, 21.У 7% развился ПГГ. Более 40% младенцев с PHH нуждались в VPS, что составляет 9,1% всех младенцев с кровотечением 2 степени или выше. По сравнению с младенцами с PIVH 2 степени, риск развития PHH был самым высоким среди детей с двусторонним PIVH 3 степени и PIVH 4/3 степеней (OR 12,2 и 13,7 соответственно), тогда как у младенцев с односторонним PIVH 3 или 4 степени он был выше. умеренные риски развития ПГГ (ОШ 3,50 и 3,79 соответственно).
Факторы риска ПГГ среди младенцев с очень низкой массой тела описаны недостаточно.Более того, в исследованиях PHH, PIVH обычно определяется самой тяжелой степенью, и информация о влиянии одностороннего PIVH скудна. Мы определили, что помимо тяжести PIVH, факторами, независимо связанными с повышенным риском PHH, были более высокий GA, PDA, требующий медикаментозного или хирургического лечения, сепсис и NEC. Связь более высокого GA и повышенного PHH, вероятно, связана с высокими показателями смертности среди наиболее недоношенных младенцев, подверженных наибольшему риску развития тяжелой PIVH и, следовательно, PHH. 1, 28 Младенцы, нуждающиеся в хирургическом вмешательстве, оказались в группе повышенного риска развития ПГГ. Это было особенно очевидно среди младенцев с хирургическим лечением КПК (OR 3,01). У недоношенных детей КПК связан с гемодинамической нестабильностью, что приводит к снижению среднего артериального давления и большей потребности в инотропах. 29 Тяжелый PIVH был связан с церебральными гемодинамическими изменениями, вызванными PDA. 30 Эта гемодинамическая нестабильность может усугубиться хирургическим вмешательством, что приведет к тяжелой PIVH и, как следствие, к увеличению риска PHH.
Несмотря на некоторое совпадение, зарегистрированные факторы риска PIVH и факторы риска, идентифицированные для PHH, не идентичны. Некоторые из них, такие как сепсис, 21 , были определены как факторы риска как для PIVH, так и для PHH. Другие факторы, которые либо снижают риск PIVH (антенатальные стероиды 7, 21 и кесарево сечение 7 ), либо повышают риск PIVH (мужской пол, 7 респираторный дистресс-синдром 7, 21 и пневмоторакс 21 ), по-видимому, не оказали никакого влияния на PHH.Разница в факторах риска может быть связана со сроками событий. Респираторные расстройства и КПК могут влиять на возникновение PIVH в течение первой недели жизни, но с меньшей вероятностью влияют на PHH, который обычно развивается через несколько недель. Сепсис может способствовать повышению риска ПГГ из-за воспалительной реакции. Воспаление может нарушить эпендимную выстилку желудочков, что приведет к нарушению нормального оттока спинномозговой жидкости, или может вызвать рубцевание паутинных грануляций, тем самым способствуя дисбалансу абсорбции спинномозговой жидкости, что приводит к развитию PHH. 31
Самая тяжелая группа PIVH по классификации Papile et al. 26 не обязательно находится в группе самого высокого риска развития ПГГ. Большой PIVH 3 степени, достаточно серьезный, чтобы вызвать дисбаланс в абсорбции спинномозговой жидкости, приведет к развитию PHH. 11 PIVH 4 степени, однако, считается результатом первичного венозного инфаркта 5 , который может не нарушать абсорбцию спинномозговой жидкости. Эта разница в патофизиологии между PIVH 3 и 4 степени может объяснить более низкую частоту PHH среди младенцев с односторонним PIVH 4 степени.Однако важно отметить, что PIVH 3 степени по определению связан с дилатацией желудочков, 26 , что может a priori привести к более высокой частоте PHH. У младенцев с PHH риск прогрессирования до VPS был самым низким в группах двустороннего PIVH 2 степени и одностороннего 3 или 4 степени (35,6%) и самым высоким у младенцев с PIVH 3/4 степени или двусторонним 4 (50,0%). Риск значительных последствий развития нервной системы значительно увеличивается, когда PIVH осложняется PHH, требующим установки шунта, с 55 до 78% для PIVH 3 степени и от 63 до 92% для PIVH 4 степени. 32 Более низкие показатели потребности в PHH и VPS у младенцев с односторонним PIVH 4 степени совместимы с отчетом Maitre et al. 4 об относительно хороших когнитивных результатах у младенцев с односторонним PIVH 4 степени.
Смерть и PHH могут рассматриваться как конкурирующие исходы, и у рано умирающих пациентов не может развиться PHH. Эта возможность подтверждается вдвое более высоким уровнем PHH среди выживших по сравнению с неживыми младенцами. Таким образом, подгрупповые анализы факторов, связанных с PHH, проводились отдельно среди выживших и выживших младенцев.У выживших младенцев группа тяжести PIVH была тесно связана с PHH с OR от 19,2 до 45,7 для тяжелых двусторонних кровотечений. У выживших респираторный дистресс-синдром и пневмоторакс были независимо связаны с PHH, тогда как у неонатальных заболеваний, включая PDA, требующие хирургического вмешательства, сепсис и NEC также были связаны с PHH. Различные ассоциации, отмеченные в этих двух группах младенцев, могут отражать время возникновения острых неонатальных заболеваний, внутрижелудочковое кровотечение и возраст смерти.База данных, однако, не включает информацию о сроках этих заболеваний, и, следовательно, определение последовательности событий, приводящих к тяжелой PIVH и впоследствии PHH, было невозможно.
При рассмотрении результатов этого исследования следует учитывать некоторые ограничения. Как уже отмечалось, невозможно оценить влияние сроков возникновения неонатальных заболеваний. Сепсис с ранним началом встречался только у 3,6% младенцев, поэтому мы не делали различия между сепсисом с ранним и более поздним началом.Предполагаемая причина смерти не сообщается, и поэтому мы не смогли определить, была ли смертность связана с тяжестью PIVH, PHH или других неонатальных заболеваний. Однако важно отметить, что младенческие смерти не могут быть связаны с прекращением медицинской помощи, что не разрешено законом в Израиле. Ультразвуковые исследования черепа, являющиеся основой для диагностики PIVH, проводятся с перерывами и различаются в зависимости от отделения новорожденных. Обычно они выполняются в первую неделю жизни и читаются на месте.У некоторых младенцев обследование не могло быть повторено до развития PHH и дальнейшего расширения кровотечения не было обнаружено, что недооценивало тяжесть PIVH. Это может объяснить, почему у младенцев, предположительно с PIVH 1 и 2 степени, которые считаются подверженными низкому риску PHH, может развиться PHH. Также возможно, что ультразвуковая диагностика PIVH низкой степени не может точно определить всю степень повреждения головного мозга, 8 , что объясняет, почему могут возникнуть дополнительные неблагоприятные неврологические исходы, такие как церебральный паралич.Требование к VPS было определено при выписке домой, и дополнительным младенцам, возможно, впоследствии потребовался более поздний VPS, без записи в базе данных. Решение о установке VPS обычно принимал лечащий нейрохирург. Не существует строго определенных единых критериев для вставки VPS, и между модулями могли иметь место различия в том, когда было выполнено VPS. Информации о хирургических или других вмешательствах по поводу постгеморрагической дилатации желудочков, кроме VPS, не регистрировалось.Наконец, база данных Израиля включает всех младенцев с очень низкой массой тела, независимо от общего возраста. Чтобы предотвратить систематическую ошибку отбора в результате невключения младенцев, родившихся на сроке беременности более 28 недель, которые могут родиться с массой тела более 1500 г, мы выбрали для этого анализа только младенцев, родившихся на сроке от 24 до 28 недель.
Несмотря на эти ограничения, в израильской национальной базе данных VLBW проспективно собраны данные о> 99% младенцев с VLBW, рожденных в Израиле. Всех младенцев наблюдают до выписки домой, даже если они переведены, что позволяет избежать систематической ошибки отбора.Все участвующие отделения интенсивной терапии новорожденных используют стандартные определения, которые оставались неизменными на протяжении всего периода исследования.

 Другие пороки клапанов приводят к тому, что они не закрываются правильно и позволяют крови течь в обратном направлении.
Другие пороки клапанов приводят к тому, что они не закрываются правильно и позволяют крови течь в обратном направлении.
 Проконсультируйтесь со своим врачом о типе и количестве антибиотика, который вам следует принять.
Проконсультируйтесь со своим врачом о типе и количестве антибиотика, который вам следует принять.