Содержание:
При беременности может возникать иммунологическая несовместимости крови матери и плода по резус-фактору, реже по системе АВ0 и еще реже по некоторым другим (система Келл, Даффи, Лютеран, Льюис, система Рр) факторам крови. В результате такой несовместимости возникает гемолитическая болезнь плода и новорожденного.
Резус-фактор и гемолитическая болезнь
Резус-фактор (Rh) является белком, который в основном содержится в эритроцитах крови человека и в гораздо меньшем количестве содержится в лейкоцитах и тромбоцитах. Различают несколько разновидностей резус-фактора. Так антиген-D присутствует в крови у 85% людей. Антиген С (Rh’) содержится в крови у 70% людей, а антиген Е (Rh») имеется у 30% людей. Кровь, в которой отсутствуют перечисленные антигены, которые представляют собой разновидности резус-фактора, является резус-отрицательной.
Чаще всего гемолитическая болезнь плода и новорожденного возникает из-за иммунологического конфликта в связи с несовместимостью крови матери и плода по фактору D. При этом материнская кровь должна быть резус-отрицательной. А кровь плода содержит резус-фактор. Гемолитическая болезнь плода и новорожденного может также возникнуть при несовместимости крови матери и плода по группе крови (по системе АВ0). Групповая принадлежность крови человека обусловлена присутствием в ней определенных антигенов. Так, наличие в крови антигена «А» обусловливает II(А) группу крови. Наличие антигена «В» — III (В) группу крови. Совместное присутствие антигенов «А» и «В» обусловливает IV (АВ) группу крови. При отсутствии обоих антигенов у человека определяется I (0) группа крови. Иммунологическая несовместимость чаще всего проявляется в том случае, если у матери имеется I (0) группа крови, а у плода II(А) или III (В). Клетки крови плода, содержащие резус-фактор или групповые антигены и обладающие соответствующей антигенной активностью, проникают в материнский кровоток. Вследствие этого происходит иммунизация женщины, что сопровождается выработкой в ее организме или антирезус-антител или антител против групповых антигенов.
Гемолитическая болезнь плода и новорожденного развивается вследствие иммунизации материнского организма, которая происходит либо уже при первой беременности плодом с резус-положительной кровью или с наличием в его крови соответствующих групповых антигенов, либо после переливания резус-положительной крови. Наиболее часто элементы крови плода, содержащие соответствующие антигены, попадают в материнский кровоток во время родов, особенно при оперативных вмешательствах, когда выполняют кесарево сечение или ручное отделение плаценты и выделение последа. Попадание элементов крови плода в материнский кровоток и последующая иммунизация женщины возможны и во время беременности при нарушении целостности ворсин плаценты, что бывает при токсикозе беременных, угрозе прерывания беременности, предлежании плаценты, при отслойке плаценты, внутриутробной гибели плода.
Принимая во внимание, что резус-фактор образуется с самых первых дней беременности, а в первые недели беременности образуются эритроциты, попадание их в материнский организм и иммунизация возможны при выполнении абортов или при внематочной беременности. После первой беременности иммунизируется около 10% женщин.
Иммунные антитела, которые выработались в организме женщины, проникают обратно в кровоток плода и воздействуют на его эритроциты. При этом происходит разрушение эритроцитов, что влечет за собой образование непрямого токсического билирубина, анемию и кислородное голодание (гипоксию). У плода развивается гемолитическая болезнь. Нарушается структура и функция печени плода, снижается выработка белка в организме плода, нарушается циркуляция крови в его организме с явлениями сердечной недостаточности. У плода в организме накапливается излишняя жидкость, что проявляется в виде отеков и асцита. Часто поражается ткань головного мозга. Развитие гемолитической болезни плода возможно уже с 22-23 недель беременности.
Диагностика гемолитической болезни
Диагностика гемолитической болезни должна быть комплексной, с применением целого ряда диагностических методик, и основывается на выявлении признаков, указывающих на иммунизацию матери, определении антител и их титра, оценке состояния плода и показателей околоплодных вод. Результаты только одного какого-либо теста не могут служить объективным и достоверным признаком возможного осложнения и требуют дополнения результатами других методов исследования.
Если в беседе с женщиной с резус-отрицательной кровью или с I(0) группой крови выясняется, что ей вводили донорскую кровь без учета резус- или групповой принадлежности, а также если у нее были самопроизвольные прерывания беременности в поздние сроки или имела место гибель плода при предыдущих беременностях, или рождение ребенка с желтушно-анемической или отечной формой , то эти факторы являются прогностически неблагоприятными с точки зрения высокого риска поражения плода при данной беременности.
Одним из простых способов определения характера течения беременности, темпов роста и развития плода и увеличения объема околоплодных вод является измерение высоты стояния дна матки (ВДМ) над лонным сочленением и измерение длины окружности живота. Эти измерения целесообразно проводить в динамике каждые две недели со II-то триместра беременности. Чрезмерное увеличение этих показателей в сравнении с нормативными для данного срока беременности в совокупности с результатами других исследований позволяет заподозрить наличие имеющейся патологии.
Определение антител в крови беременной имеет относительное диагностическое значение, и должно быть использовано для выявления данной патологии только в комплексе с другими диагностическими тестами. Важным признаком является величина титра антител и его изменение по мере развития беременности. Титр антител соответствует наибольшему разведению сыворотки, при котором она еще способна воздействовать (агглютинировать) резус-положительные эритроциты (титр антител может быть равен 1:2, 1:4, 1:8, 1:16 и т. д.). Соответственно, чем больше титр, тем больше антител и тем менее благоприятен прогноз.
Титр антител в течение беременности может нарастать, быть неизменным, снижаться, а также может отмечаться попеременный подъем и спад титра антител. В последнем случае вероятность заболевания плода наиболее велика.
Оценка состояния плода и фето-плацентарного комплекса
Для оценки состояния плода и фето-плацентарного комплекса могут быть использованы такие инструментальные методы диагностики как кардиотокография (КТГ) и ультразвуковое исследование. По данным КТГ в случае страдания плода отмечаются явные признаки нарушения сердечного ритма плода, урежение сердцебиений, монотонный ритм и т.п. При ультразвуковом исследовании оценивают размеры плода, состояние его внутренних органов, структуру и толщину плаценты, объем околоплодных вод. Определяют также функциональную активность плода и с помощью допплерографии изучают интенсивность кровотока в системе мать-плацента-плод.
Ультразвуковое исследование у женщин с ожидаемой гемолитической болезнью плода следует проводить в 20-22 нед., 24-26 нед., 30-32 нед., 34-36 нед. и незадолго до родоразрешения. До 20 недель беременности признаки гемолитической болезни эхографически не выявляются. Повторные исследование необходимы для исключения в динамике гемолитической болезни плода. У каждой беременной сроки повторных сканирований вырабатываются индивидуально, при необходимости интервал между исследованиями сокращается до 1-2 недель.
Принимая во внимание, что при гемолитической болезни плода происходит отек плаценты, то ее утолщение на 0,5 см и более может свидетельствовать о возможном заболевание плода. Однако при этом следует исключить и другие осложнения, при которых также может происходить утолщение плаценты (например, внутриутробное инфицирование или сахарный диабет).
Для гемолитической болезни плода наряду с утолщением плаценты возможно и увеличение размеров его живота по сравнению с грудной клеткой и головкой плода. Такое увеличение обусловлено чрезмерными размерами печени плода, а также излишним скоплением жидкости в его брюшной полости (асцит). Отек тканей плода проявляется в виде двойного контура его головки. При выраженной водянке плода дополнительно также отмечаются скопление жидкости в других полостях (гидроторакс, гидроперикард), признаки отека стенок кишечника.
При ультразвуковом сканировании оцениваются и поведенческие реакции плода (двигательная активность, дыхательные движения, тонус плода). При нарушении его состояния отмечаются соответствующие патологические реакции со стороны этих показателей. По данным допплерографии отмечается снижение интенсивности кровотока в фето-плацентарном комплексе.
Важное диагностическое значение имеет определение в околоплодных водах оптической плотности билирубина, группы крови плода, титра антител. Накануне родоразрешения околоплодные воды целесообразно исследовать для оценки степени зрелости легких плода.
Для исследования околоплодных вод, начиная с 34-36 недель беременности, выполняют амниоцентез, который представляет собой пункцию полости матки для взятия пробы околоплодных вод. Процедуру проводят под ультразвуковым контролем с обезболиванием и с соблюдением всех правил асептики и антисептики.
Амниоцентез может быть выполнен либо через переднюю брюшную стенку, либо через канал шейки матки. Место пункции выбирают в зависимости от расположения плаценты и положения плода. Возможными осложнениями при этом могут быть: повышение тонуса матки, отслойка плаценты, кровотечение, излитие околоплодных вод и начало родовой деятельности, развитие воспаления.
По величине оптической плотности билирубина в околоплодных водах, если она более 0,1, оценивают возможную степень тяжести гемолитической болезни плода. При величине этого показателя более 0,2 можно ожидать рождение ребенка со средней и тяжелой формой гемолитической болезни.
Выявление группы крови плода по околоплодным водам является одним из тестов, определяющих прогноз для плода. Чаще можно ожидать развитие гемолитической болезни вследствие несовместимости по резус-фактору, при одногруппной крови матери и плода.
Важное значение имеет определение группы крови при подозрении на развитие АВ0-конфликтной беременности. Значимым диагностическим тестом является определение титра антител в околоплодных водах.
Для исследования крови плода используют пункцию сосудов пуповины (кордоцентез) под ультразвуковым контролем. Исследование полученной таким образом крови плода позволяет определить его группу крови и резус-принадлежность, оценить уровень гемоглобина, белка сыворотки крови и ряда других показателей, отражающих наличие и тяжесть осложнения.
В рамках ведения беременности у всех пациенток и их мужей следует определить резус-принадлежность и группу крови при первом обращении к врачу, не зависимо от того, предстоят ли роды или планируется прерывание беременности. У беременных с первой группой крови, если у их мужей другая группа крови, необходимо провести исследование на определение групповых антител. Беременных с резус-отрицательной кровью необходимо обследовать на наличие антител и их титра 1 раз в месяц до 20 недель, а далее 1 раз в 2 недели. Если у беременной с резус-положительной кровью имеется указание на рождение ребенка с гемолитической болезнью, следует исследовать кровь на наличие групповых иммунных антител, а также на «анти – с» антитела, если кровь мужа содержит антиген «с». Наличие резус-сенсибилизации у беременных не является показанием для прерывания беременности.
Профилактика и лечение гемолитической болезни плода
Всем беременным с резус-отрицательной кровью, даже при отсутствии у них в крови антител, а также при наличии АВ0 сенсибилизации следует провести в амбулаторных условиях 3 курса неспецифической десенсибилизирующей терапии продолжительностью по 10-12 дней, в сроки 10-22, 22-24, 32-34 недели.
В рамках проведения неспецифической десенсибилизирующей терапии назначают: внутривенное введение 20 мл 40% раствора глюкозы с 2 мл 5% раствора аскорбиновой кислоты, 100 мг кокарбоксилазы; внутрь рутин по 0,02 г 3 раза в день, теоникол по 0,15 г 3 раза в день или метионин по 0,25 г и кальция глюконата по 0,5 — 3 раза, препараты железа, витамин Е по 1 капсуле. На ночь применяют антигистаминные препараты: димедрол 0,05 или супрастин 0,025.
При осложненном течении беременности: угроза прерывания, ранний токсикоз беременных, гестоз и пр., пациентки должны быть госпитализированы в отделение патологии беременных, где наряду с лечением основного заболевания проводится курс десенсибилизирующей терапии.
Беременным, у которых имеется высокий титр резус-антител, а в анамнезе у них были самопроизвольные выкидыши или роды плодом с отечной или тяжелой формой гемолитической болезни, рекомендуется применять плазмоферез. Эта процедура позволяет удалить из плазмы крови антитела. Плазмоферез проводят 1 раз в неделю под контролем титра антител, начиная с 23-24 нед. беременности, до родоразрешения.
Для лечения гемолитической болезни плода применяется также гемосорбция с использованием активированных углей для удаления из крови антител и уменьшения степени резус-сенсибилизации. Гемосорбцию применяют у беременных с крайне отягощенным акушерским анамнезом (повторные выкидыши, рождение мертвого ребенка). Гемосорбцию начинают проводить с 20-24 недель в стационаре, с интервалом в 2 недели.
Лечение гемолитической болезни плода во время беременности возможно также путем переливания крови плоду под ультразвуковым контролем.
Беременных с резус-сенсибилизацией госпитализируют в родильный дом в 34-36 нед. беременности. При АВ0 — сенсибилизации госпитализация осуществляется в 36-37 недель. При наличии соответствующих показаний, указывающих на выраженный характер осложнения, госпитализация возможна и в более ранние сроки.
При наличии гемолитической болезни плода целесообразно досрочное родоразрешение в связи с тем, что к концу беременности увеличивается поступление антител к плоду. При выраженной гемолитической болезни плода беременность прерывают в любые сроки беременности. Однако в большинстве случаев беременность удается пролонгировать до приемлемых сроков родоразрешения. Как правило, родоразрешение проводится через естественные родовые пути. Кесарево сечение выполняют при наличии дополнительных акушерских осложнений.
В родах проводят тщательный контроль за состоянием плода, осуществляют профилактику гипоксии. Сразу после рождения ребенка быстро отделяют от матери. Из пуповины берется кровь для определения содержания билирубина, гемоглобина, группы крови ребенка, его резус-принадлежности. Проводится специальный тест, позволяющий выявить эритроциты новорожденного, связанные с антителами.
Лечение гемолитической болезни новорожденного
При гемолитической болезни новорожденного различают три ее формы: анемическую, желтушную и отечню. При лечении анемической формы гемолитической болезни новорожденных при цифрах гемоглобина менее 100 г/л проводят переливания резус-положительной эритромассы, соответствующей группе крови новорожденного. Для лечения желтушно-анемической формы гемолитической болезни новорожденных применяют заменное переливание крови, фототерапию, инфузионную терапию. При тяжелом течении гемолитической болезни новорожденного заменное переливание крови выполняется неоднократно в комплексе с терапией, направленной на снижение интоксикации, обусловленной непрямым билирубином.
Действие фототерапии или светолечения направлено на разрушение непрямого билирубина в поверхностных слоях кожи новорожденного под воздействием лампы дневного света или синего (длина волны 460А). При выполнении инфузионной терапии внутривенно капельно вводят растворы гемодеза, глюкозы, альбумина, плазмы в различных комбинациях.
Лечение отечной формы гемолитической болезни новорожденного заключается в немедленном заменном переливании одногруппной резус-отрицательной эритро-массы. Одновременно проводится дегидратационная терапия, направленная на устранение отеков.
Для предотвращения гемолитической болезни плода и новорожденного необходимо, чтобы при любом переливании крови она была одногруппной и сходной по резус-принадлежности.
Первая беременность и резус-конфликт
Важно сохранять первую беременность у женщин с резус-отрицательной кровью. Необходимо проводить профилактику и лечение осложненной беременности, а также осуществлять десенсибилизирующую терапию. Первобеременным женщинам с резус-отрицательной кровью, которые еще не сенсибилизированы к резус-фактору, на 28 неделе беременности или после досрочного прерывания беременности, или после аборта вводят антирезусный иммуноглобулин. После родов в первые 48-72 часа введение иммуноглобулина повторяют.
ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЁННОГО
Изосерологическая несовместимость крови матери и плода — несовместимость крови матери и плода по системе резус или АВ0.
Гемолитическая болезнь плода/новорождённого (ГБП/ГБН) — заболевание, характеризующееся гемолизом эритроцитов и/или угнетением гемопоэза под влиянием АТ, образующихся у матери к Аг эритроцитов плода, взаимно проникающих через плацентарный барьер, проявляющееся анемией, увеличением числа бластных форм эритроцитов, часто билирубина в крови плода/новорождённого.
СИНОНИМЫ
Эритробластоз плода, гемолитическая желтуха новорождённого.
Резус-сенсибилизация, резус-конфликт, изоиммунизация, аллоиммунизация, групповая несовместимость.
КОД ПО МКБ-10
Класс XV Беременность, роды и послеродовый период (O00–О99)
Медицинская помощь матери в связи с состоянием плода, амниотической полости и возможными трудностями
родоразрешения (О30–О48).
O36 Медицинская помощь матери при других установленных или предполагаемых патологических состояниях плода.
О36.0 Резус-иммунизация, требующая предоставления медицинской помощи матери.
О36.1 Другие формы иммунизации, требующие предоставления медицинской помощи матери.
Класс XVI Отдельные состояния, возникающие в перинатальном периоде (P00–P96)
Геморрагические и гематологические нарушения у плода и новорождённого (P50–P61).
P55 Гемолитическая болезнь плода и новорождённого.
Р55.0 Резус-изоиммунизация плода и новорождённого.
Р55.1 АВ0-изоиммунизация плода и новорождённого.
Р55.8 Другие формы гемолитической болезни плода и новорождённого.
Р55.9 Гемолитическая болезнь плода и новорождённого неуточнённая.
P56 Водянка плода, обусловленная гемолитической болезнью.
Р56.0 Водянка плода, обусловленная изоимунизацией.
Р56.9 Водянка плода, обусловленная другой неуточнённой гемолитической болезнью.
P57 Ядерная желтуха.
Р57.0 Ядерная желтуха, обусловленная изоиммунизацией.
P58 Неонатальная желтуха, обусловленная чрезмерным гемолизом.
ЭПИДЕМИОЛОГИЯ
ГБН, обусловленная несовместимостью крови матери и плода по системе АВ0, развивается в 10–20% случаев, при этом в 40 раз чаще у женщин с группой крови 0. Тяжёлые формы заболевания наблюдают в единичных случаях (1:3000 родов). Резус-сенсибилизация возможна при беременности, возникшей у супружеской пары, в которой мать имеет резус-отрицательную кровь, а отец — резус-положительную. Частота встречаемости резус-отрицательной принадлежности крови зависит от этнической принадлежности. Наиболее часто она выявляется у испанских басков — 30–32%, почти отсутствует у африканцев, у европейцев наблюдается у 15–16% населения.
ЭТИОЛОГИЯ (ПРИЧИНЫ) ГЕМОЛИТИЧЕСКОЙ БОЛЕЗНИ ПЛОДА И НОВОРОЖДЕННОГО
При резус-несовместимости кровь матери — резус-отрицательная, а у плода — резус-положительная. Выявление у женщин с резус-отрицательной кровью антирезус-АТ указывает на сенсибилизацию к Аг системы резус.
Изоиммунизация может также развиться и в результате несовместимости крови матери и плода по другим системам эритроцитарных Аг, например, системе АВ0, когда у матери 0 (I) группа крови, а у плода любая другая. Аг А и В плода могут проникать во время беременности в кровоток матери, приводя к выработке иммунных α- и β-АТ соответственно и развитию у плода реакции «Аг-АТ» (Аα, Вβ). Групповая несовместимость крови матери и плода, хотя и встречается чаще, чем несовместимость по другим системам Аг, но ГБП и ГБН при этом протекают легче и, как правило, не требуют интенсивной терапии.
Наибольшее клиническое значение имеет изосерологическая несовместимость по системе Аг Резус, так как 95% всех выраженных форм ГБП обусловлены несовместимостью по Аг D системы Резус (Rh) и только 5% — по другим системам эритроцитов. ГБП/ГБН может быть обусловлена несовместимостью по нескольким Аг одной или разных эритроцитарных систем.
Система Резус — система аллогенных эритроцитарных Аг человека, дифференциация которого начинается в ранние сроки внутриутробного развития (с 6–8-й недели беременности). Впервые белковый фактор в эритроцитах, обладающий антигенными свойствами, был обнаружен американскими учёными К. Ландштейнером и А. Винером в 1940 году. Ими в эксперименте показано, что эритроциты обезьян (макака-резус), введённые кроликам, вызывали у последних выработку АТ.
В настоящее время выделяют 6 основных Аг системы Rh (Dd, Cc, Ee). Каждый генный комплекс состоит из трёх антигенных детерминант: D или отсутствие D, С или с, Е или е в различных комбинациях. Существование Аг d до настоящего времени не подтверждено, так как не имеется гена, отвечающего за синтез указанного Аг. Несмотря на это, символ d применяется в иммуногематологии для обозначения факта отсутствия Аг D на эритроцитах при описании фенотипов.
Другими изосерологическими системами крови, с которыми может быть связан иммунологический конфликт, являются системы Келл–Челлано, Даффи, Кидд, MNSs, Лютеран и др. (табл. 38-1).
Таблица 38-1. Распределение антигенов эритроцитов по иммунологическому риску образовывать агрессивные антиэритроцитарные антитела
| Высокий | Низкий | Очень низкий | Отсутствует |
| D (система Резус) | e (система Резус) | S (система MNSs) | Lea (система Льюис) |
| K (система Келл) | Ce (система Резус) | U (система Келл) | Leb (система Льюис) |
| C (система Резус) | Kpa (система Келл) | M (система MNSs) | P (система Р) |
| E (система Резус) | Kpb (система Келл) | Fyb (система Даффи) | |
| C (система Резус) | CE (система Резус) | N (система MNSs) | |
| Fya (система Даффи) | k (система Келл) | Doa (система Домброк) | |
| s (система MNSs) | Coa (система Колтон) | ||
| Dia (система Диего) | |||
| Dib (система Диего) | |||
| Lu a (система Лютеран) | |||
| Yta (система Картрайт) | |||
| Jka (система Кидд) |
Наибольшее практическое значение имеет Аг Rh0(D) — основной Аг системы Резус. Он содержится на эритроцитах 85% людей, проживающих в Европе. Именно на основании наличия на эритроцитах Аг Rh0(D) выделяют резус- положительный тип крови. Кровь людей, эритроциты которых лишены этого Аг, относят к резус-отрицательному типу.
Люди с резус-положительной кровью могут быть гомозиготными (DD) и гетерозиготными (Dd). Если отец гомозиготен (DD), что отмечается у 40–45% всех мужчин с резус-положительной кровью, то доминантный ген D всегда передаётся плоду. Следовательно, у женщины с резус-отрицательной кровью (dd) плод будет Rh-положительным в 100% случаев.
Если отец гетерозиготен (Dd), что наблюдается у 55–60% всех резус-положительных мужчин, то плод будет резус- положительным в 50% случаев, так как возможно наследование и доминантного, и рецессивного гена. Определение гетерозиготности отца представляет определённые трудности и не может быть внедрено в рутинную практику.
Поэтому беременность у женщины с резус-отрицательной кровью от мужчины с резус-положительной кровью следует вести как беременность плодом с резус-положительной кровью.
ПАТОГЕНЕЗ
Иммунизация женщин с резус-отрицательной кровью происходит при беременности плодом с резус-положительной кровью в результате плодово-материнской трансфузии. Возможна также ятрогенная изоиммунизация вследствие введения в организм резус-отрицательной женщины резус-положительной крови (гемотрансфузия).
При физиологической беременности эритроциты плода проникают через плаценту у 3% женщин в первом, у 15% — во втором, у 45% — в третьем триместрах беременности. Объём фетальной крови в кровотоке матери возрастает с увеличением срока беременности и достигает около 30–40 мл в родах. Поэтому сенсибилизация может наступать после искусственного и самопроизвольного аборта, внематочной беременности. Наиболее часто трансплацентарная трансфузия наблюдается во время родов, особенно при оперативных вмешательствах (ручное отделение плаценты, КС). В процессе беременности резус-иммунизации способствует нарушение целостности ворсин хориона, вследствие чего происходит попадание эритроцитов плода в кровоток матери (гестоз, угроза прерывания беременности, преждевременная отслойка плаценты, экстрагенитальная патология, проведение инвазивных процедур – биопсии хориона, амниоцентеза, кордоцентеза). Степень риска резус-иммунизации при оценке различных анамнестических факторов представлена в табл. 38-2.
Таблица 38-2. Степень риска резус-иммунизации
| Факторы риска иммунизации | Риск иммунизации, % |
| Самопроизвольный аборт | 3–4 |
| Искусственный аборт | 2–5 |
| Внематочная беременность | <1 |
| Доношенная беременность (до родоразрешения) | 1–2 |
| Роды при совместимости по АВ0-системе | 16 |
| Роды при АВ0-несовместимости | 2–3,5 |
| Инвазивные процедуры | 1–3 |
| Переливание резус-положительной крови | 90–95 |
Первичным ответом матери на попадание в кровоток резус-Аг является выработка I- M («полные» АТ), которые имеют крупную молекулярную массу, не проникают через плацентарный барьер и поэтому не имеют значения в развитии ГБП. При повторном попадании резус-Аг в сенсибилизированный организм матери происходит быстрая и массивная продукция I- — («неполные» АТ), которые вследствие низкой молекулярной массы легко проникают через плаценту и являются причиной развития ГБП. I- — состоят из 4-х субклассов, значительно отличающихся по своей агрессивности к эритроцитам. Агрессивными являются I- — первого и третьего субклассов.
Выработанные АТ, проникая из кровотока беременной к плоду, вступают в реакцию с Аг эритроцитов плода (реакция «Аг-АТ»). При этом происходит их гемолиз с образованием непрямого токсичного билирубина. Разрушение эритроцитов является основной причиной развивающейся у плода анемии, а накопление непрямого билирубина приводит к развитию желтухи.
В результате развившейся гемолитической анемии стимулируется синтез эритропоэтина. Когда образование в костном мозге эритроцитов не может компенсировать их разрушение, возникает экстрамедуллярное кроветворение в печени, селезёнке, надпочечниках, почках, плаценте и слизистой оболочке кишечника плода. Это приводит к обструкции портальной и пуповинной вен, портальной гипертензии, нарушению белковосинтезирующей функции печени — гипопротеинемии. Снижается коллоидно-осмотическое давление крови, результатом чего являются асцит, генерализованные отёки у плода. Компенсаторно увеличивается сердечный выброс и минутный объём, формируется гипердинамический тип кровообращения. Наблюдается гипертрофия миокарда, в дальнейшем — СН. Тяжесть состояния плода обусловлена также прогрессирующей тканевой гипоксией, нарастанием ацидоза.
Поскольку непрямой билирубин хорошо растворяется в липидах, он в первую очередь поражает ядра клеток головного мозга, что в периоде новорождённости способствует развитию билирубиновой энцефалопатии и ядерной желтухи.
Таким образом, анемия и высокий уровень билирубина являются основными наиболее часто встречающимися симптомами ГБП, при тяжёлых формах заболевания возможно развитие водянки у плода вплоть до анасарки.
Редкая встречаемость тяжёлых форм ГБП и ГБН при АВ0 несовместимости объясняется рядом факторов: связыванием большого количества анти-А и анти-В АТ с Аг А и Аг В, растворёнными в тканях плаценты, плазме крови, ОВ; структурой Аг А и Аг В фетальных эритроцитов, позволяющей связывать только небольшое количество АТ, даже если их много; преимущественным наличием анти-А и анти-В АТ в виде I- — 2.
Существует и другой патогенетический вариант развития заболевания, при котором анемия, развивающаяся у плода/новорождённого имеет не гемолитический, а апластический характер. Этот вариант развивается при несовместимости крови матери и плода по Аг К (система Келл). Анти-К АТ вызывают не гемолиз эритроцитов, а угнетение гемопоэза у плода, поэтому в его крови и АЖ будут отсутствовать повышенные уровни билирубина, в клинической картине заболевания у новорождённого не наблюдается желтухи.
КЛИНИЧЕСКАЯ КАРТИНА (СИМПТОМЫ) НЕСОВМЕСТИМОСТИ КРОВИ МАТЕРИ И ПЛОДА
Специфическая клиническая картина заболевания у беременных отсутствует, хотя некоторые авторы описывают так называемый «зеркальный синдром», при котором параллельно с нарастанием проявлений «внутриутробной катастрофы» у матери наблюдается комплекс симптомов, в целом напоминающий гестоз.
Заболевание диагностируют на основании данных лабораторного и инструментального исследования.
ДИАГНОСТИКА
ДИАГНОСТИКА РЕЗУССЕНСИБИЛИЗАЦИИ
Диагностика резус-сенсибилизации у матери основывается на результатах изучения анамнеза, определения наличия/отсутствия титра эритроцитарных АТ в её периферической крови. Диагностика ГБП основана на данных ультразвуковой фето-, плацентометрии, исследования количества ОВ, ультразвуковых признаках наличия отёка у плода, допплерометрического исследования мозгового кровотока плода с целью выявления анемии, оценки функционального состояния плода. При получении неинвазивных данных о наличии анемии проводится амнио- и кордоцентез с последующей гемотрансфузией.
Наличие в анамнезе женщины с резус-отрицательной кровью гемотрансфузии без учёта резус-принадлежности её крови, самопроизвольного прерывания беременности, антенатальной смерти плода в предыдущих беременностях или рождения ребёнка с ГБН являются прогностически неблагоприятными и указывают на повышенный риск заболевания плода при данной беременности.
У пациенток с резус-отрицательной кровью необходимо с ранних сроков (6–12 нед) или при первом обращении исследовать кровь на наличие антиэритроцитарных АТ и определять их титр в динамике (1 раз в месяц на протяжении всей беременности).
Титр АТ соответствует наибольшему разведению сыворотки, при котором в ней ещё возможна реакция агглютинации «Аг-АТ» (титр АТ может быть равен 1:2, 1:4, 1:8, 1:16 и т.д.). Абсолютная величина титра АТ в крови матери при определении степени тяжести заболевания плода не имеет решающего значения для прогноза развития заболевания у плода/новорождённого (возможно рождение детей с резус-отрицательной кровью у резус-сенсибилизированных женщин). Титр АТ в течение беременности может нарастать, оставаться без изменений, снижаться, а иногда наблюдается скачкообразное изменение титра (чередующиеся повышение и понижение), что имеет относительное значение.
ДИАГНОСТИКА ГЕМОЛИТИЧЕСКОЙ БОЛЕЗНИ ПЛОДА
Большое значение в диагностике ГБП имеет УЗИ с фето- и плацентометрией. Для определения первых признаков ГБП УЗИ целесообразно производить, начиная с 18–20 нед. До этого срока ультразвуковые признаки ГБП, как правило, не выявляются. В дальнейшем УЗИ проводят по показаниям, в зависимости от динамики ультразвуковых и допплерометрических данных. При благоприятных результатах у сенсибилизированных больных желательно проводить исследования в динамике не реже одного раза в 2–3 нед, при тяжёлых формах ГБП УЗИ иногда проводят каждые 1–3 дня.
Одним из ультразвуковых признаков ГБП является увеличение толщины плаценты — превышение нормальной для срока беременности толщины плаценты на 0,5–1,0 см. На наличие ГБП указывают также увеличение размеров печени, селезёнки плода (органы экстрамедуллярного кровообращения), многоводие. Дополнительным ультразвуковым критерием заболевания может служить расширенная вена пуповины (более 10 мм).
Наиболее точно при УЗИ ставится диагноз отёчной формы ГБП, критериями которой являются выраженная плацентомегалия (до 6,0–8,0 см), гепатоспленомегалия, асцит, многоводие (рис. 38-1). К патологическим ультразвуковым признакам при выраженной водянке плода относятся также кардиомегалия и перикардиальный выпот, гидроторакс, повышенная эхогенность кишечника вследствие отёка его стенки, отёк подкожной клетчатки головы, туловища и конечностей плода.
Рис. 38-1. Отёчная форма гемолитической болезни плода, эхограмма (а – плацентомегалия, б – асцит).
В настоящее время ведущее место в диагностике анемии у плода занимает допплерометрическое исследование максимальной скорости кровотока в средней мозговой артерии. Увеличение максимальной скорости кровотока, выраженной в МоМ, более 1,5 для срока беременности с высокой чувствительностью и специфичностью свидетельствует о развитии у плода гипердинамического типа кровообращения, характерного для тяжёлой анемии (рис. 38-2). При получении таких данных проводят инвазивную уточняющую диагностику — амнио- и кордоцентез.
Рис. 38-2. Кровоток в средней мозговой артерии при гемолитической болезни плода, допплерограмма.
Учитывая, что гипербилирубинемия является одним из основных признаков ГБП, для диагностики заболевания возможно определять оптическую плотность ОВ, повышающуюся по мере увеличения концентрации в них билирубина (оптической плотности) за счёт выделения почками плода. Величину оптической плотности билирубина в ОВ можно определять, используя фотоэлектроколориметр или, предпочтительнее, спектрофотометр с длиной волны 450 нм. В 34–35 нед уровень оптической плотности билирубина менее 0,1 отн.ед. свидетельствует об отсутствии заболевания плода. Повышение оптической плотности билирубина происходит при развитии ГБП: значения 0,1–0,15 указывают на лёгкую степень заболевания, 0,15–0,2 — среднюю; оптическая плотность билирубина более 0,2 с большой вероятностью позволяет предположить наличие тяжёлой формы ГБП. Более точно и в более ранние сроки беременности (начиная с 24 нед) оценить тяжесть ГБП возможно при исследовании оптической плотности билирубина в АЖ при различных длинах волн света (от 300 до 700 нм) с помощью спектрофотометра. Полученные значения оптической плотности билирубина интерпретируют согласно шкале Лили, которая делится на зоны: 1, 2А, 2В, 2С, 3 (рис. 38-3).
Рис. 38-3. Шкала Лили.
Если значение оптической плотности билирубина соответствует первой зоне, плод следует считать здоровым или резус-отрицательным. Если значение оптической плотности билирубина соответствует третьей зоне шкалы Лили, то при сроке гестации до 34 нед показано проведение кордоцентеза и внутриутробного переливания крови, после 34-й недели следует провести родоразрешение.
Долгое время метод Лили считали одним из основных для диагностики степени тяжести ГБП. Однако в настоящий момент этот метод представляет исторический интерес, имеет относительное значение, поскольку он неинформативен при апластическом характере анемии у плода, промежуточные его значения (2-я зона) не дают чётких представлений о тяжести заболевания и требуют выполнения повторных инвазивных вмешательств, усиливающих сенсибилизацию. Поэтому его используют только в качестве дополнительного метода при диагностических кордоцентезах.
Наиболее точным методом выявления ГБП и степени её тяжести является исследование плодовой крови, полученной путем кордоцентеза (пункции пуповины). Кордоцентез проводят с 18 нед беременности. Единственным показанием к нему являются данные допплерометрии, свидетельствующие о наличии у плода анемии, поскольку только тяжёлая анемия является показанием к внутриутробному лечению. Другие показания к выполнению инвазивных вмешательств у сенсибилизированных пациенток отсутствуют, поскольку все они усиливают сенсибилизацию.
При проведении кордоцентеза кровь плода исследуют на группу и резус-принадлежность, уровни Hb и Ht, можно выполнить непрямую пробу Кумбса и определение билирубина.
Нормативные показатели Hb и Ht у плода в различные сроки гестации представлены в табл. 38-3.
Таблица 38-3. Показатели гемоглобина и гематокрита у здоровых плодов
| Срок беременности, нед | 24–25 | 26–29 | 30–33 | 34 |
| Hb (г/л) | 113±17 | 125±9 | 129±12 | 144±13 |
| Ht (%) | 35±3 | 38±3 | 39±3 | 44±5 |
Анемию у плода считают легкой при 0,65 < Hb < 0,84 МоМ, средней — при 0,55 < Hb <0,65 МоМ, тяжёлой — при Hb < 0,55 МоМ для срока беременности. Противопоказаниями к проведению кордоцентеза является выраженная угроза прерывания беременности.
При проведении кордоцентеза возможны следующие осложнения: кровотечение из места пункции пуповины; гематома пуповины; плодово-материнские кровотечения; отслойка плаценты; острая гипоксия плода; преждевременное излитие вод; преждевременные роды; инфицирование. Антенатальные потери наблюдаются в 0,5–2% наблюдений.
В последние годы разработан и начинает использоваться в практике метод, позволяющий исследовать фетальные эритроциты в периферической крови матери с целью диагностики резус-принадлежности крови плода. Установленная в ранние сроки беременности резус-отрицательная принадлежность крови плода (точность диагностики до 100%) позволяет избежать необоснованных инвазивных диагностических вмешательств.
Учитывая, что ГБП нередко сопровождается его гипоксией, необходимо оценить его функциональное состояние при КТГ. Интерпретацию кардиотокограмм производят согласно шкале оценки сердечной деятельности плода.
Регистрация при КТГ кривой «синусоидального» типа свидетельствует о наличии тяжёлой формы ГБП. При признаках нарушения функционального состояния плода мониторинг необходимо проводить ежедневно.
В большинстве случаев ультразвуковая фето- и плацентометрия, оценка скорости кровотока в средней мозговой артерии плода, результаты амниоцентеза и кордоцентеза позволяют выработать правильную тактику ведения пациентки. План ведения зависит от срока беременности, состояния плода и уровня перинатальной службы в данном учреждении (возможность проведения внутриматочных гемотрансфузий и выхаживания недоношенных детей).
ДИАГНОСТИКА ГЕМОЛИТИЧЕСКОЙ БОЛЕЗНИ НОВОРОЖДЁННОГО
Сразу после рождения ребёнка у женщин с резус-отрицательной кровью или резус-сенсибилизацией необходимо произвести определение резус-принадлежности и группы крови новорождённого, содержания Hb и билирубина в крови, взятой из пуповины.
В раннем неонатальном периоде выделяют три основные клинические формы ГБН:
• гемолитическая анемия без желтухи и водянки;
• гемолитическая анемия с желтухой;
• гемолитическая анемия с желтухой и водянкой.
Гемолитическая анемия без желтухи и водянки — наиболее лёгкая форма заболевания. У детей при рождении отмечается бледность кожных покровов, в крови снижен уровень Hb (менее 140 г/л). Желтуха отсутствует или проявляется на 2–3-и сут, выражена незначительно и исчезает к 7–10-му дню.
Гемолитическая анемия с желтухой встречается наиболее часто и характеризуется желтушным окрашиванием кожных покровов и слизистых оболочек при рождении или вскоре после рождения (в отличие от физиологической желтухи, которая проявляется на 2–3 сутки). Отмечается увеличение печени и селезёнки; наряду со снижением Hb в периферической крови новорождённого наблюдается гипербилирубинемия.
Без проведения лечебных мероприятий в ближайшие 2–3 дня интенсивность желтухи нарастает, общее состояние ухудшается, появляются симптомы билирубиновой интоксикации (вялость, снижение врождённых безусловных рефлексов, приступы апноэ). Возможно развитие билирубиновой энцефалопатии (ядерной желтухи): беспокойство, усиление тонуса разгибательной мускулатуры, тонические судороги, симптом «заходящего солнца».
Гемолитическая анемия с желтухой и водянкой является наиболее тяжёлым проявлением заболевания, нередко заканчивающейся внутриутробной гибелью плода или смертью новорождённого. При этой форме наблюдаются выраженная анемия и тромбоцитопения, генерализованные отёки, скопление жидкости в серозных полостях (асцит, гидроперикард, гидроторакс) и геморрагический синдром. Печень, селезёнка резко увеличены и уплотнены вследствие наличия очагов экстрамедуллярного кроветворения. ГБН классифицируется также по степени тяжести в зависимости от выраженности гемолиза (табл. 38-4).
Таблица 38-4. Критерии степени тяжести гемолитической болезни новорождённых
| Клинические признаки | Степень тяжести ГБН | ||
| лёгкая | средняя | тяжелая | |
| Анемия (Hb в пуповинной крови) | >150 г/л(>15 г%) | 149–100 г/л(15,1–10,0 г%) | < 100 г/л(<10 г%) |
| Желтуха (билирубин в пуповинной крови) | <85,5 мкмоль/л(<5,0 мг%) | 85,6–136,8 мкмоль/л(5,1–8,0 мг%) | >136,9 мкмоль/л(>8,0 мг%) |
| Отёчный синдром | Пастозность подкожной клетчатки | Пастозность и асцит | Универсальный отёк |
ЛЕЧЕНИЕ НЕСОВМЕСТИМОСТИ КРОВИ МАТЕРИ И ПЛОДА
Лечение изосерологической несовместимости крови матери и плода не проводят. К настоящему времени признаны неэффективными методы, «снижающие» степень сенсибилизации (уровень титра АТ): неспецифическая десенсибилизирующая терапия, трансплантация кожного лоскута от мужа, гемосорбция, плазмоферез.
Лечение ГБП состоит во внутрисосудистой гемотрансфузии плоду при среднетяжёлой и тёжелой анемии.
Внутриутробное переливание крови повышает уровень Hb и Ht, снижает риск развития отёчной формы ГБП и позволяет пролонгировать беременность. Кроме того, переливание плоду отмытых эритроцитов способствует ослаблению иммунного ответа организма беременной за счёт снижения относительного количества резус- положительных эритроцитов и поддержанию Ht плода на уровне выше критического.
Для внутрисосудистой гемотрансфузии проводят кордоцентез и осуществляют забор крови плода для определения предтрансфузионного Ht плода. После получения пробы плодовой крови рассчитывают необходимый объем трансфузии с учётом уровней Ht плода, донорской крови и срока беременности. Для внутриутробного переливания крови используют эритроцитную массу (отмытые эритроциты 0(I) группы резус-отрицательной крови), скорость введения не должна превышать 1–2 мл/мин. С целью оптимизации условий проведения трансфузии возможно проведение миорелаксации плода введением раствора ардуана; для борьбы с отёчным синдромом гемотрансфузию сочетают с переливанием 20% раствора альбумина.
По окончании гемотрансфузии производят контрольный забор крови плода для определения посттрансфузионного Ht и Hb с целью оценки эффективности процедуры.
Необходимость повторных гемотрансфузий определяется сроком беременности. При решении вопроса о сроках проведения повторных гемотрансфузий учитывают показатели максимальной систолической скорости кровотока в средней мозговой артерии плода.
Внутриутробные переливания крови могут проводиться неоднократно до 32–34 нед беременности, после этого гестационного возраста решают вопрос о досрочном родоразрешении.
Лечение ГБН. Лёгкая форма ГБН требует ежедневного контроля уровня Hb, Ht и билирубина. По показаниям проводят коррекцию анемии резус-отрицательной эритроцитарной массой, соответствующей группе крови новорождённого. Эритроцитную массу следует переливать через катетер, введённый в центральную или периферическую вену, с помощью шприцевого насоса со скоростью 10–12 мл/ч, желательно под контролем АД, ЧСС и диуреза.
Показана также инфузионная терапия, направленная на дезинтоксикацию организма новорождённого, повышение билирубиносвязывающей способности альбумина крови и коррекцию метаболических нарушений. В состав инфузионных сред включаются следующие растворы: 10% раствор глюкозы, 5% раствор альбумина по 8–10 мл/кг, плазма по 10–15 мл/кг. Общий объём вводимой жидкости должен составлять 100–150% физиологической потребности новорождённого.
Параллельно проводят фототерапию, которая направлена на разрушение в коже новорождённого непрямого билирубина до его водорастворимых дериватов. Для светолечения используют лампы дневного или синего света с длиной волны 460–480 нм. Фототерапию проводят в кювезе в непрерывном или импульсном режиме.
Лечение детей с ГБН средней тяжести, помимо вышеуказанных инфузионной терапии и фототерапии включает также внутрижелудочное капельное (со скоростью 10–12 мл/ч) введение жидкости в целях предотвращения холестаза и абсорбции билирубина, экскретируемого в кишечник. Общий объём жидкости должен составлять 60–70 мл/кг массы тела (плазма 10–15 мл/кг, раствор 25% магния сульфата 5–8 мл/кг, 4% раствор хлористого калия 5–8 мл/кг, 5% раствор глюкозы).
Основным методом лечения гипербилирубинемии у новорождённого является заменное переливание крови.
Заменное переливание крови делят на раннее (в 1–2-е сут жизни) и позднее (с 3-х суток жизни). Раннее заменное переливание крови проводят с целью выведения из кровотока новорождённого билирубина и заблокированных АТ эритроцитов, повышения уровня Hb. Целью позднего заменного переливания крови является, в основном, предупреждение билирубиновой интоксикации.
Показания к раннему заменному переливанию крови:
• содержание общего билирубина в пуповинной крови более 100 мкмоль/л;
• почасовой прирост билирубина более 10 мкмоль/л для доношенного ребёнка, почасовой прирост 8 мкмоль/л для недоношенного ребёнка.
Показания к позднему заменному переливанию крови:
• содержание общего билирубина более 308–340 мкмоль/л у доношенного ребенка и более 272–290 мкмоль/л у недоношенного ребёнка массой тела более 2 кг.
При ГБН, вызванной резус-конфликтом, для заменного переливания крови используют одногруппную резус- отрицательную кровь или смесь резус-отрицательной эритроцитарной массы и одногруппной с ребёнком плазмы. При несовместимости по групповым факторам необходимо переливание эритроцитной массы 0(I) группы (соответственно резус-принадлежности ребёнка) и одногруппной плазмы.
Прикладывание к груди проводят после уменьшения желтухи и снижения билирубина при общем удовлетворительном состоянии ребёнка, как правило, с 5–6-го дня жизни. АТ, содержащиеся в молоке, не проникают через кишечную стенку в силу своей крупнодисперсности и не оказывают вредного влияния на уровень Hb.
При отёчной форме ГБН необходимо немедленное восполнение ОЦК и коррекция уровня Hb для борьбы с выраженной гипоксией и анемией. В связи с сердечно-сосудистой недостаточностью первое заменное переливание крови возможно провести «малым» объёмом из расчёта 60–70 мл/кг эритроцитарной массы.
При выраженной дыхательной недостаточности, обусловленной отёком лёгких, показано проведение ИВЛ до купирования лёгочной недостаточности. При выраженном асците лапароцентез проводят под контролем УЗИ. Для предупреждения гипотонии у новорождённого асцитическую жидкость следует выводить медленно. В связи с выраженной СН, обусловленной дистрофией миокарда, показаны терапия сердечными гликозидами по общепринятой методике, ранняя профилактика холестаза.
Проведение фототерапии при отёчной форме заболевания ограничено, так как в первые дни жизни у ребёнка наблюдается накопление большого количества прямого билирубина и возможно такое осложнение, как «синдром бронзового младенца».
ТАКТИКА ВЕДЕНИЯ РОДОВ
Способ родоразрешения беременных с резус-сенсибилизацией зависит от состояния плода, срока беременности, паритета и подготовленности родовых путей.
При отсутствии клинических признаков тяжёлой формы заболевания плода, сроке беременности, близком к доношенному (свыше 36 нед), и зрелой шейке матки роды ведут через естественные родовые пути. Если заболевание плода расценивают как тяжёлое, то предпочтительнее оперативное родоразрешение, так как КС позволяет избежать дополнительной травматизации больного плода во время родов.
ПРОФИЛАКТИКА РЕЗУССЕНСИБИЛИЗАЦИИ
Решение проблемы резус-сенсибилизации заключается в своевременном проведении профилактических мероприятий, которые включают:
• осуществление любого переливания крови с учётом резус-принадлежности крови пациентки и донора;
• сохранение первой беременности у женщин с резус-отрицательной кровью;
• специфическая профилактика у женщин с резус-отрицательной кровью без явлений сенсибилизации путем введения иммуноглобулина человека антирезус Rho[D] после любого прерывания беременности (роды резус-положительным плодом, аборты, внематочная беременность).
Для специфической профилактики резус-сенсибилизации используют иммуноглобулин человека антирезус Rho[D] (специфические АТ). Эффект иммуноглобулина человека антирезус Rho[D] обусловлен механизмом торможения иммунного ответа за счёт связывания имеющихся в организме матери Аг.
Препарат вводят по одной дозе (300 мкг) внутримышечно однократно: родильнице не позже, чем через 72 ч после родов (желательно в течение первых двух часов), после искусственного прерывания беременности и при внематочной беременности непосредственно по окончании операции. После КС, ручного отделения плаценты, а также при отслойке плаценты дозу препарата необходимо удвоить (600 мкг).
Очень важна также антенатальная профилактика резус-сенсибилизации всем беременным с резус-отрицательной кровью и отсутствием резус-АТ в сыворотке крови. Это обусловлено тем, что трансплацентарный переход эритроцитов плода в материнский кровоток происходит с 28 нед беременности, и начало сенсибилизации может происходить до родоразрешения. Поэтому в 28 нед гестации все неиммунизированные беременные с резус- отрицательной кровью при условии, что отец плода резус-положительный, должны получать профилактически 300 мкг иммуноглобулина человека антирезус Rho[D], который не проходит через плаценту и специально разработан для антенатальной профилактики резус-сенсибилизации. Антенатальную профилактику проводят также после инвазивных процедур (биопсия хориона, амниоцентез, кордоцентез) независимо от срока беременности.
Если в 28 нед проводилась профилактика иммуноглобулином человека антирезус Rho[D], то определение резус-АТ в крови беременной не имеет клинического значения!
При рождении ребёнка с резус-положительной кровью инъекцию иммуноглобулина человека антирезус Rho[D] осуществляют повторно после родов в течение первых 72 ч.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Женщины детородного возраста должны знать резус-принадлежность своей крови. Женщины с резус-отрицательной кровью должны быть информированы о целесообразности сохранения первой беременности, а также о необходимости профилактики резус-сенсибилизации путём введения антирезус-иммуноглобулина после абортов и внематочной беременности.
При планировании беременности женщине необходимо также знать резус-принадлежность и группу крови отца будущего ребёнка. Все неиммунизированные беременные с резус-отрицательной кровью должны быть осведомлены о необходимости профилактического введения иммуноглобулина человека антирезус Rho[D] после диагностических инвазивных процедур (биопсия хориона, амниоцентез, кордоцентез) в 28 нед беременности, а также после родов (не позже, чем через 72 ч).
Женщинам с резус-сенсибилизацией и чрезвычайно отягощённым анамнезом (гибель детей от ГБН) необходимо знать о возможности наступления беременности плодом с резус-отрицательной кровью с помощью ЭКО. При ЭКО в процессе преимплантационной диагностики отбираются и переносятся в матку именно те эмбрионы, которые наследуют материнскую резус-отрицательную кровь. При этом обязательным условием является гетерозиготность отца по резус-фактору (Dd), когда в 50% возможно ожидать, что плод будет с резус-отрицательной кровью.
ПРОГНОЗ
Зависит от тяжести заболевания плода и своевременности начатого лечения при ГБП и ГБН. Более благоприятный прогноз при ГБП и ГБН, обусловленной несовместимостью крови матери и плода по АВ0.
Резус-конфликт беременных — это несочетаемость белков крови матери и плода. Появляется, если резус-фактор у матери отрицательный, а у отца положительный резус. Вероятность конфликта составляет 50%, риск увеличивается при повторных беременностях.
Таблицы вероятности
Чтобы рассчитать вероятность развития резус-конфликта, нужно знать, какой фактор у отца и матери. Для быстрого подсчёта созданы таблицы. Конфликт бывает не только по резус-фактору, но и по группе крови. Обозначается белок буквами Rh.
По резус-фактору
Таблица определения резус-фактора плода по крови отца и матери.
| Отец | Мать | Ребенок | Вероятность несовместимости из-за разного резуса |
|---|---|---|---|
| + | + | 75%+, 25% — | Нет |
| + | — | 50%+, 50% — | Есть |
| — | + | 50%+, 50% — | Нет |
| — | — | — | Нет |
По группе крови

Конфликт по группе крови тоже бывает, но он не сопровождается тяжёлыми негативными последствиями. Высокая вероятность группового конфликта наблюдается, если у отца 3 или 4 группа, а у матери 1 или 2 группа.
Причины патологии
Резус-фактор — это белок, который находится на поверхности эритроцитов. Это кровяные клетки, переносящие кислород. Белок был обнаружен учеными в начале XX века у мартышек резусов. В человеческой популяции белок обнаруживается у 85% людей. Их называют положительными (Rh+). У 15% людей этого белка нет, их называют отрицательными (Rh—).
Если кровяные клетки с резус-белком попадают в организм человека без этого фактора, возникает резус-конфликт. Он заключается в образовании антител против белка, из-за этого разрушаются эритроциты, несущие на себе резус-белок.
При беременности несочетаемость матери и плода возникает только в одном случае — если у матери кровь не имеет Rh, а кровь плода его содержит. В крови плода Rh появляется, если он есть в крови отца. Вероятность появления Rh-положительного плода в таком случае составляет 50%. Риск развития конфликта тоже составляет 50%.
Если у матери положительная по Rh кровь, конфликт не возникнет. При этом не имеет значения, какая кровь у отца — отрицательная по Rh или положительная.
На каком сроке начинается резус-конфликт

Формирование резусного белка в крови плода завершается к восьмой неделе беременности. С этого срока может проявиться несовместимость. Возникает она не в 100% случаев. С 50%-ной вероятностью плод будет резус-отрицательный, как и мать. Тогда конфликта при беременности не будет.
Если же плод получил Rh от отца, то при первой беременности вероятность несовместимости матери и ребенка составляет лишь 10%. При последующих беременностях риск осложнений возрастает. Это связано с тем, что во время первой беременности организм матери еще не знаком с резусным белком, антитела вырабатываются в небольшом количестве. А в последующие разы антитела на резусный фактор у матери вырабатываются быстрее и в большем количестве.
Симптомы резус-конфликта матери и плода
Из-за действия материнских антител эритроциты в крови плода разрушаются. У ребенка развивается анемия, кислородная недостаточность. Сама беременная не ощущает ухудшения самочувствия.
Состояние ребенка оценивают с помощью УЗИ. Первый признак начинающейся гемолитической болезни — увеличение печени и селезёнки плода. Кардиотокография отслеживает частоту сердцебиений плода. При нехватке кислорода она увеличивается более 120 в минуту.
Последствия резус-конфликта при беременности

При разрушении эритроцитов в кровь плода выделяется билирубин — пигмент желтого цвета, образующийся в печени. Большое количество билирубина токсично, он негативно влияет на функцию внутренних органов ребенка. Такое состояние называется гемолитической болезнью плода. Тяжелое течение гемолитической болезни приводит к внутриутробной гибели плода.
Гемолитическая болезнь развивается достаточно редко. Даже если появляется резус-конфликт, плод защищён хорошо. Плацента задерживает большинство антител из кровотока матери. Ослаблять защиту могут:
- хронические заболевания матери;
- вредные привычки;
- отслойка плаценты;
- выраженный токсикоз.
У здоровой беременной эритроциты плода практически не проникают в ее кровоток. Поэтому антитела не вырабатываются. Повышают риск смешивания крови прокол плодных оболочек для забора околоплодных вод на исследование, прокол пуповины плода.
Гемолитическая болезнь у родившегося ребенка проявляется в трех формах.
- Отечная — самый тяжелый вариант. Характерны множественные отеки, в том числе и внутриполостные. Кожа бледная, внутренние органы увеличены.
- Желтушная — малыш рождается с желтой кожей, белками глаз. Протекает относительно легко.
- Анемическая — легкая форма. Малыш бледный, вялый, с плохим аппетитом.
Осложнение чаще возникает при желтушной форме, и называется ядерной желтухой. Это повреждение токсичным билирубином коры головного мозга.
Конфликт резус-факторов у родителей
При планировании беременности важно провести определение группы крови и Rh у обоих родителей. Если женщина окажется Rh-отрицательной, ей назначают анализ крови на антитела к Rh. При отрицательном анализе следующее исследование проводят в 18-20 недель беременности. Если анализ отрицательный, в 28 недель женщине вводят антирезусный иммуноглобулин. Это препарат, который предотвращает образование антител.
При положительном анализе женщина сдаёт анализ ежемесячно до 32 недели. Затем анализ берут 2 раза в месяц до 36 недели, а потом еженедельно до родов.
Проводимые мероприятия при обнаружении резус-конфликта матери и плода
Если количество антител у матери будет расти, ее направляют в отделение патологии беременных. Здесь беременность доводят до конца под медицинским наблюдением. Состояние ребенка регулярно отслеживают с помощью ультразвукового исследования, кардиотокографии.
При ухудшении состояния ребенка проводят переливание донорской эритромассы через пуповину. Под контролем УЗИ прокалывают брюшную стенку матери, вводят катетер в пуповину, переливают до 30 мл резус-отрицательной крови.
Родившегося малыша лечат фототерапией. Это облучение ультрафиолетом, который выводит излишки билирубина из кровотока. Проводят плазмаферез — очищение плазмы крови специальным аппаратом. Резусная несовместимость — довольно редкое явление. Наиболее опасна она при повторных беременностях. Приводит к разрушению эритроцитов плода и развитию гемолитической болезни. Лечение проводят путем переливания донорских эрироцитов внутриутробно и после рождения.
При беременности может возникать иммунологическая несовместимости крови матери и плода по резус-фактору , реже по системе АВ0 и еще реже по некоторым другим ( система Келл, Даффи, Лютеран, Льюис, система Рр ) факторам крови. В результате такой несовместимости возникает гемолитическая болезнь плода и новорожденного.
Резус-фактор и гемолитическая болезнь
 Резус-фактор (Rh) является белком, который в основном содержится в эритроцитах крови человека и в гораздо меньшем количестве содержится в лейкоцитах и тромбоцитах. Различают несколько разновидностей резус-фактора. Так антиген-D присутствует в крови у 85% людей. Антиген С (Rh’) содержится в крови у 70% людей, а антиген Е (Rh») имеется у 30% людей. Кровь, в которой отсутствуют перечисленные антигены, которые представляют собой разновидности резус-фактора, является резус-отрицательной.
Резус-фактор (Rh) является белком, который в основном содержится в эритроцитах крови человека и в гораздо меньшем количестве содержится в лейкоцитах и тромбоцитах. Различают несколько разновидностей резус-фактора. Так антиген-D присутствует в крови у 85% людей. Антиген С (Rh’) содержится в крови у 70% людей, а антиген Е (Rh») имеется у 30% людей. Кровь, в которой отсутствуют перечисленные антигены, которые представляют собой разновидности резус-фактора, является резус-отрицательной.
Чаще всего гемолитическая болезнь плода и новорожденного возникает из-за иммунологического конфликта в связи с несовместимостью крови матери и плода по фактору D. При этом материнская кровь должна быть резус-отрицательной. А кровь плода содержит резус-фактор. Гемолитическая болезнь плода и новорожденного может также возникнуть при несовместимости крови матери и плода по группе крови (по системе АВ0). Групповая принадлежность крови человека обусловлена присутствием в ней определенных антигенов. Так, наличие в крови антигена «А» обусловливает II(А) группу крови. Наличие антигена «В» — III (В) группу крови. Совместное присутствие антигенов «А» и «В» обусловливает IV (АВ) группу крови. При отсутствии обоих антигенов у человека определяется I (0) группа крови. Иммунологическая несовместимость чаще всего проявляется в том случае, если у матери имеется I (0) группа крови, а у плода II(А) или III (В). Клетки крови плода, содержащие резус-фактор или групповые антигены и обладающие соответствующей антигенной активностью, проникают в материнский кровоток. Вследствие этого происходит иммунизация женщины, что сопровождается выработкой в ее организме или антирезус-антител или антител против групповых антигенов.
Гемолитическая болезнь плода и новорожденного развивается вследствие иммунизации материнского организма , которая происходит либо уже при первой беременности плодом с резус-положительной кровью или с наличием в его крови соответствующих групповых антигенов, либо после переливания резус-положительной крови. Наиболее часто элементы крови плода, содержащие соответствующие антигены, попадают в материнский кровоток во время родов, особенно при оперативных вмешательствах, когда выполняют кесарево сечение или ручное отделение плаценты и выделение последа. Попадание элементов крови плода в материнский кровоток и последующая иммунизация женщины возможны и во время беременности при нарушении целостности ворсин плаценты, что бывает при токсикозе беременных, угрозе прерывания беременности, предлежании плаценты, при отслойке плаценты, внутриутробной гибели плода.
Принимая во внимание, что резус-фактор образуется с самых первых дней беременности, а в первые недели беременности образуются эритроциты, попадание их в материнский организм и иммунизация возможны при выполнении абортов или при внематочной беременности. После первой беременности иммунизируется около 10% женщин.
Иммунные антитела , которые выработались в организме женщины, проникают обратно в кровоток плода и воздействуют на его эритроциты. При этом происходит разрушение эритроцитов, что влечет за собой образование непрямого токсического билирубина, анемию и кислородное голодание (гипоксию). У плода развивается гемолитическая болезнь. Нарушается структура и функция печени плода, снижается выработка белка в организме плода, нарушается циркуляция крови в его организме с явлениями сердечной недостаточности. У плода в организме накапливается излишняя жидкость, что проявляется в виде отеков и асцита. Часто поражается ткань головного мозга. Развитие гемолитической болезни плода возможно уже с 22-23 недель беременности.
Диагностика гемолитической болезни
Диагностика гемолитической болезни должна быть комплексной, с применением целого ряда диагностических методик, и основывается на выявлении признаков, указывающих на иммунизацию матери, определении антител и их титра, оценке состояния плода и показателей околоплодных вод. Результаты только одного какого-либо теста не могут служить объективным и достоверным признаком возможного осложнения и требуют дополнения результатами других методов исследования.
Если в беседе с женщиной с резус-отрицательной кровью или с I(0) группой крови выясняется, что ей вводили донорскую кровь без учета резус- или групповой принадлежности, а также если у нее были самопроизвольные прерывания беременности в поздние сроки или имела место гибель плода при предыдущих беременностях, или рождение ребенка с желтушно-анемической или отечной формой, то эти факторы являются прогностически неблагоприятными с точки зрения высокого риска поражения плода при данной беременности.
Одним из простых способов определения характера течения беременности, темпов роста и развития плода и увеличения объема околоплодных вод является измерение высоты стояния дна матки (ВДМ) над лонным сочленением и измерение длины окружности живота. Эти измерения целесообразно проводить в динамике каждые две недели со II-то триместра беременности. Чрезмерное увеличение этих показателей в сравнении с нормативными для данного срока беременности в совокупности с результатами других исследований позволяет заподозрить наличие имеющейся патологии.
Определение антител в крови беременной имеет относительное диагностическое значение, и должно быть использовано для выявления данной патологии только в комплексе с другими диагностическими тестами. Важным признаком является величина титра антител и его изменение по мере развития беременности. Титр антител соответствует наибольшему разведению сыворотки, при котором она еще способна воздействовать (агглютинировать) резус-положительные эритроциты (титр антител может быть равен 1:2, 1:4, 1:8, 1:16 и т. д.). Соответственно, чем больше титр, тем больше антител и тем менее благоприятен прогноз.
Титр антител в течение беременности может нарастать, быть неизменным, снижаться, а также может отмечаться попеременный подъем и спад титра антител. В последнем случае вероятность заболевания плода наиболее велика.
Оценка состояния плода и фето-плацентарного комплекса
Для оценки состояния плода и фето-плацентарного комплекса могут быть использованы такие инструментальные методы диагностики как кардиотокография (КТГ) и ультразвуковое исследование. По данным КТГ в случае страдания плода отмечаются явные признаки нарушения сердечного ритма плода, урежение сердцебиений, монотонный ритм и т.п. При ультразвуковом исследовании оценивают размеры плода, состояние его внутренних органов, структуру и толщину плаценты, объем околоплодных вод. Определяют также функциональную активность плода и с помощью допплерографии изучают интенсивность кровотока в системе мать-плацента-плод .
Ультразвуковое исследование у женщин с ожидаемой гемолитической болезнью плода следует проводить в 20—22 нед., 24—26 нед., 30—32 нед., 34—36 нед. и незадолго до родоразрешения. До 20 недель беременности признаки гемолитической болезни эхографически не выявляются. Повторные исследование необходимы для исключения в динамике гемолитической болезни плода. У каждой беременной сроки повторных сканирований вырабатываются индивидуально, при необходимости интервал между исследованиями сокращается до 1—2 недель.
Принимая во внимание, что при гемолитической болезни плода происходит отек плаценты , то ее утолщение на 0,5 см и более может свидетельствовать о возможном заболевание плода. Однако при этом следует исключить и другие осложнения, при которых также может происходить утолщение плаценты (например, внутриутробное инфицирование или сахарный диабет).
Для гемолитической болезни плода наряду с утолщением плаценты возможно и увеличение размеров его живота по сравнению с грудной клеткой и головкой плода. Такое увеличение обусловлено чрезмерными размерами печени плода, а также излишним скоплением жидкости в его брюшной полости (асцит). Отек тканей плода проявляется в виде двойного контура его головки. При выраженной водянке плода дополнительно также отмечаются скопление жидкости в других полостях (гидроторакс, гидроперикард), признаки отека стенок кишечника.
При ультразвуковом сканировании оцениваются и поведенческие реакции плода (двигательная активность, дыхательные движения, тонус плода). При нарушении его состояния отмечаются соответствующие патологические реакции со стороны этих показателей. По данным допплерографии отмечается снижение интенсивности кровотока в фето-плацентарном комплексе.
Важное диагностическое значение имеет определение в околоплодных водах оптической плотности билирубина , группы крови плода, титра антител. Накануне родоразрешения околоплодные воды целесообразно исследовать для оценки степени зрелости легких плода.
Для исследования околоплодных вод, начиная с 34—36 недель беременности, выполняют амниоцентез , который представляет собой пункцию полости матки для взятия пробы околоплодных вод. Процедуру проводят под ультразвуковым контролем с обезболиванием и с соблюдением всех правил асептики и антисептики.
Амниоцентез может быть выполнен либо через переднюю брюшную стенку, либо через канал шейки матки. Место пункции выбирают в зависимости от расположения плаценты и положения плода. Возможными осложнениями при этом могут быть: повышение тонуса матки, отслойка плаценты, кровотечение, излитие околоплодных вод и начало родовой деятельности, развитие воспаления.
По величине оптической плотности билирубина в околоплодных водах, если она более 0,1, оценивают возможную степень тяжести гемолитической болезни плода. При величине этого показателя более 0,2 можно ожидать рождение ребенка со средней и тяжелой формой гемолитической болезни.
Выявление группы крови плода по околоплодным водам является одним из тестов, определяющих прогноз для плода. Чаще можно ожидать развитие гемолитической болезни вследствие несовместимости по резус-фактору, при одногруппной крови матери и плода.
Важное значение имеет определение группы крови при подозрении на развитие АВ0-конфликтной беременности . Значимым диагностическим тестом является определение титра антител в околоплодных водах.
Для исследования крови плода используют пункцию сосудов пуповины ( кордоцентез ) под ультразвуковым контролем. Исследование полученной таким образом крови плода позволяет определить его группу крови и резус-принадлежность, оценить уровень гемоглобина, белка сыворотки крови и ряда других показателей, отражающих наличие и тяжесть осложнения.
В рамках ведения беременности у всех пациенток и их мужей следует определить резус-принадлежность и группу крови при первом обращении к врачу, не зависимо от того, предстоят ли роды или планируется прерывание беременности . У беременных с первой группой крови, если у их мужей другая группа крови, необходимо провести исследование на определение групповых антител. Беременных с резус-отрицательной кровью необходимо обследовать на наличие антител и их титра 1 раз в месяц до 20 недель, а далее 1 раз в 2 недели. Если у беременной с резус-положительной кровью имеется указание на рождение ребенка с гемолитической болезнью, следует исследовать кровь на наличие групповых иммунных антител, а также на «анти – с» антитела, если кровь мужа содержит антиген «с». Наличие резус-сенсибилизации у беременных не является показанием для прерывания беременности.
Профилактика и лечение гемолитической болезни плода
Всем беременным с резус-отрицательной кровью, даже при отсутствии у них в крови антител, а также при наличии АВ0 сенсибилизации следует провести в амбулаторных условиях 3 курса неспецифической десенсибилизирующей терапии продолжительностью по 10-12 дней, в сроки 10-22, 22-24, 32-34 недели.
В рамках проведения неспецифической десенсибилизирующей терапии назначают: внутривенное введение 20 мл 40% раствора глюкозы с 2 мл 5% раствора аскорбиновой кислоты, 100 мг кокарбоксилазы; внутрь рутин по 0,02 г 3 раза в день, теоникол по 0,15 г 3 раза в день или метионин по 0,25 г и кальция глюконата по 0,5 — 3 раза, препараты железа, витамин Е по 1 капсуле. На ночь применяют антигистаминные препараты: димедрол 0,05 или супрастин 0,025.
При осложненном течении беременности: угроза прерывания, ранний токсикоз беременных, гестоз и пр., пациентки должны быть госпитализированы в отделение патологии беременных, где наряду с лечением основного заболевания проводится курс десенсибилизирующей терапии.
Беременным, у которых имеется высокий титр резус-антител , а в анамнезе у них были самопроизвольные выкидыши или роды плодом с отечной или тяжелой формой гемолитической болезни, рекомендуется применять плазмоферез . Эта процедура позволяет удалить из плазмы крови антитела. Плазмоферез проводят 1 раз в неделю под контролем титра антител, начиная с 23—24 нед. беременности, до родоразрешения.
Для лечения гемолитической болезни плода применяется также гемосорбция с использованием активированных углей для удаления из крови антител и уменьшения степени резус-сенсибилизации. Гемосорбцию применяют у беременных с крайне отягощенным акушерским анамнезом (повторные выкидыши, рождение мертвого ребенка). Гемосорбцию начинают проводить с 20-24 недель в стационаре, с интервалом в 2 недели.
Лечение гемолитической болезни плода во время беременности возможно также путем переливания крови плоду под ультразвуковым контролем .
Беременных с резус-сенсибилизацией госпитализируют в родильный дом в 34-36 нед. беременности. При АВ0 — сенсибилизации госпитализация осуществляется в 36-37 недель. При наличии соответствующих показаний, указывающих на выраженный характер осложнения, госпитализация возможна и в более ранние сроки.
При наличии гемолитической болезни плода целесообразно досрочное родоразрешение в связи с тем, что к концу беременности увеличивается поступление антител к плоду. При выраженной гемолитической болезни плода беременность прерывают в любые сроки беременности. Однако в большинстве случаев беременность удается пролонгировать до приемлемых сроков родоразрешения. Как правило, родоразрешение проводится через естественные родовые пути. Кесарево сечение выполняют при наличии дополнительных акушерских осложнений.
В родах проводят тщательный контроль за состоянием плода, осуществляют профилактику гипоксии . Сразу после рождения ребенка быстро отделяют от матери. Из пуповины берется кровь для определения содержания билирубина, гемоглобина, группы крови ребенка, его резус-принадлежности. Проводится специальный тест, позволяющий выявить эритроциты новорожденного, связанные с антителами.
Лечение гемолитической болезни новорожденного
При гемолитической болезни новорожденного различают три ее формы: анемическую, желтушную и отечную . При лечении анемической формы гемолитической болезни новорожденных при цифрах гемоглобина менее 100 г/л проводят переливания резус-положительной эритромассы, соответствующей группе крови новорожденного. Для лечения желтушно-анемической формы гемолитической болезни новорожденных применяют заменное переливание крови, фототерапию, инфузионную терапию . При тяжелом течении гемолитической болезни новорожденного заменное переливание крови выполняется неоднократно в комплексе с терапией, направленной на снижение интоксикации, обусловленной непрямым билирубином.
Действие фототерапии или светолечения направлено на разрушение непрямого билирубина в поверхностных слоях кожи новорожденного под воздействием лампы дневного света или синего (длина волны 460А). При выполнении инфузионной терапии внутривенно капельно вводят растворы гемодеза, глюкозы, альбумина, плазмы в различных комбинациях.
Лечение отечной формы гемолитической болезни новорожденного заключается в немедленном заменном переливании одногруппной резус-отрицательной эритро-массы. Одновременно проводится дегидратационная терапия, направленная на устранение отеков .
Для предотвращения гемолитической болезни плода и новорожденного необходимо, чтобы при любом переливании крови она была одногруппной и сходной по резус-принадлежности.
Первая беременность и резус-конфликт
Важно сохранять первую беременность у женщин с резус-отрицательной кровью . Необходимо проводить профилактику и лечение осложненной беременности, а также осуществлять десенсибилизирующую терапию. Первобеременным женщинам с резус-отрицательной кровью, которые еще не сенсибилизированы к резус-фактору, на 28 неделе беременности или после досрочного прерывания беременности, или после аборта вводят антирезусный иммуноглобулин . После родов в первые 48-72 часа введение иммуноглобулина повторяют.
Запись к специалистам по телефону единого колл-центра: +7(495)636-29-46 (м. «Щукинская» и «Улица 1905 года»). Вы можете также записаться к врачу на нашем сайте, мы Вам перезвоним!
ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДАОсновой изосерологической несовместимости крови матери и плода является неоднородность у них антигенных факторов эритроцитов крови, чаще по системе резус, реже по системе АВО. Вследствие проникновения факторов крови плода, обладающих антигенными свойствами, в кровоток матери, у которой они отсутствуют, в ее организме вырабатываются аллоиммунные антитела, которые через плаценту проникают к плоду, и в его организме возникает реакция антиген—антитело. Подобная реакция приводит к агглютинации и гемолизу эритроцитов плода, анемии, образованию непрямого билирубина — к гемолитической болезни плода и новорожденного (ГБП и ГБН). При изосерологической несовместимости крови матери и плода заболевание может проявляться как во время беременности (ГБП), так и после рождения ребенка (ГБН). Гемолитическая болезнь (синоним: эритробластоз) нередко является причиной смерти плода и новорожденного, повышенной заболеваемости в постнатальном периоде и последующие годы жизни. Значительное снижение перинатальной смертности и заболеваемости детей было достигнуто благодаря применению заменного переливания крови новорожденным с ГБН, а также введением матери антирезус-иммуноглобулина (Rh IgG) после прерывания беременности любым путем (аборт, внематочная беременность, роды). Введенный Rh IgG связывает Rh-антигены, которые могут поступать в кровоток матери при прерывании беременности, и тем самым предотвращает выработку материнских антител и Rh-иммунзацию. Издавна акушеры знали о заболеваниях (семейная желтуха, эритробластоз) новорожденных, сопровождающихся желтухой, нередко со смертельным исходом. Однако причина и патогенез гемолитической болезни стали известны только с 1940 г., когда американские ученые K.Landsteiner и A.Wiener обнаружили белковый фактор в эритроцитах, который обладал антигенными свойствами. Этими учеными в эксперименте было показано, что эритроциты обезьян (макака-резус) при введении кроликам вызывали у последних выработку антител. Реакция антиген—антитело (сыворотка иммунизированного кролика и эритроциты человека), выражающаяся в агглютинации, была обнаружена у 15 % людей. У остального населения подобный антиген, названный D-фактором, резус-фактором (Rh), содержится в эритроцитах, а также может быть в лейкоцитах, тромбоцитах и других клетках тканей. В последующем было доказано, что, помимо резус-фактора, в эритроцитах могут быть обнаружены и другие антигены, качественно отличающиеся друг от друга, — С (Rh’) и Е (Rh»). Антиген С (Rh’) содержится в крови 70 % людей, антиген Е (Rh») — 30 %. По существу кровь может считаться резус-отрицательной только в тех случаях, когда в ней отсутствуют все 3 разно видности резус-фактора. Резус-отрицательная кровь не лишена антигенных свойств, в ней обнаруживают связанные с эритроцитами аллели антигенов С, D, Е: с, d, e (система Нг), из них только антиген с может иметь значение в развитии иммуноконфликта в системе мать—плод. Сложность системы резус обусловливается большим количеством мутаций каждого гена. Наследование резус-антигенов определяется серией аллельных генов, расположенных на одной хромосоме, причем гены D и d, Сие, Еие находятся во взаимоисключающих отношениях. Присутствие D-антигена на эритроцитах обусловлено геном D, который имеет аллель d. Таким образом, возможны 3 генотипа: DD — гомозиготный, Dd — гетерозиготный и dd — гомозиготный. Все 3 гена одной хромосомы наследуются одновременно. Гемолитическая болезнь плода и новорожденного может развиться также при несовместимости крови матери и плода по система АВО. Антигены А и В плода могут проникать во время беременности в кровоток матери, приводя к выработке иммунных а- и р-антител соответственно и развитию у плода реакции антиген—антитело (Аа, ВР). При этом иммунологическая несовместимость проявляется в том случае, если у матери 0(1) группа крови, а у плода — А(П) или В(Ш). Групповая несовместимость крови матери и плода встречается чаще (1 случай на 200—256 родов), но ГБП и ГБН протекают легче. Это объясняется защитной функцией околоплодных оболочек и околоплодных вод. Значительно реже ГБП и ГБН возникают при несовместимости крови матери и плода по другим эритроцитарным антигенам: Келл (К, к), Даффи (Fya—Fyb), Кидд (Ika), MNSs, PP, Лютеран (Lua—Lub), Льюис и др. Гемолитическая болезнь плода. Этиология и патогенез. ГБП и ГБН развиваются в том случае, если кровь матери резус-отрицательная, а кровь плода резус-положительная. Однако заболевание возможно также при резус-положительной крови матери и резус-отрицательной крови плода, при сенсибилизации к антигену с. Как правило, ГБП и ГБН возникают после предшествующей резус-иммунизации, которая может наступить после попадания даже небольшого количества эритроцитов, содержащих Rh, в кровоток матери: переливание крови без учета резус-принадлежности, внутримышечное введение крови, а также попадание резус-положительных эритроцитов в кровоток матери во время предыдущей или настоящей беременности, сопровождающейся нарушением целости ворсин хориона или плаценты. Резус-фактор формируется в ранние сроки беременности (по некоторым данным, начиная с 3—8-го дня беременности), эритроциты плода в крови беременных могут появляться при сроке 6—8 нед. Продолжительность циркуляции эритроцитов плода в кровотоке матери точно не установлена, однако известно, что аборты в ранние сроки гестации и внематочная беременность способствуют иммунизации — выработке антител в материнском организме. Роды особенно часто являются причиной попадания антигенов в кровоток матери с ее последующей сенсибилизацией. Опасность сенсибилизации увеличивается при оперативных родах, особенно во время кесарева сечения и ручного отделения плаценты. В меньшей степени вероятно попадание эритроцитов плода в кровоток матери в процессе беременности, но и это не исключено при наличии факторов, способствующих нарушению целости ворсин хориона и плаценты: амниоцентез, угроза прерывания беременности, предлежание плаценты, отслойка плаценты, наружный поворот плода, внутриутробная смерть плода. Даже небольшое количество антигена, попадающее в кровоток матери, может оказать выраженное сенсибилизирующее воздействие, вызвать выработку антител. Иммунизация может произойти и в процессе первой беременности, так как эритроциты плода могут попасть в кровоток матери, начиная с I триместра (6,7 %). Во II триместре гестации эритроциты плода обнаруживают у 15,9 %, в III — у 28,9 % беременных. Для иммунизации достаточно введения женщине с резус-отрицательной кровью 0,1 мл резус-положительной крови (этот факт доказан G.K.Cohen и соавт. в 1964 г. в экспериментах на добровольцах). Раз возникнув, антитела не исчезают, и чувствительность к повторному попаданию в организм резус-положительных эритроцитов велика. После первой беременности иммунизируются 10 % женщин, но и при последующих беременностях возможна иммунизация такого же числа женщин, если она не произошла после первой беременности. Тяжесть течения ГБП во многом зависит от вида антител, продуцируемых иммунной системой матери. Основную роль в развитии ГБП играют неполные антитела, относящиеся к IgG, которые легко проникают через плацентарный барьер. Полные антитела, относящиеся к IgM, имеют большую молекулярную массу и практически не проникают через плацентарный барьер. Антирезус-антитела матери, попадая в кровоток плода, вызывают агглютинацию его эритроцитов или сначала их блокаду, а затем агглютинацию. В последующем независимо от варианта воздействия комплексы эритроцитов разрушаются, выделяется большое количество непрямого билирубина, возникают анемия и гипербилирубинемия. Если эритроциты не разрушаются в кровяном русле, то они накапливаются в селезенке и там подвергаются гемолизу под воздействием фагоцитов. Обычно в том случае, если в организме появляется непрямой билирубин, он быстро переводится в прямой путем присоединения двух молекул глюкуроновой кислоты, вырабатываемой в печени. Прямой билирубин выводится почками. Непрямой билирубин плода может в определенном количестве выводиться трансплацентарно, а затем переходить в прямой в организме матери. Однако часть непрямого билирубина циркулирует в организме плода, чему способствует функциональная незрелость его печени. Кроме того, увеличение очагов эритропоэза в печени, расширение желчных протоков желчью, подвергшейся сгущению, приводят к изменению паренхимы печени и нарушению ее архитектоники. Последствиями этого являются уменьшение продукции протеинов в печени, гипопротеинемия, портальная гипертензия, асцит и генерализованные отеки. У плода при гемолитической болезни наряду с гипербилирубинемией возникают анемия и, следовательно, тканевая гипоксия с ацидозом. Непрямой билирубин является жирорастворимым, поэтому легко проникает в ткани, богатые липидами, подавляя ферментативные процессы. В связи с этим при гипербилирубинемии часто поражается мозговая ткань, особенно ядра головного мозга. В зависимости от степени иммунизации ГБП может развиться в различные сроки беременности, иногда очень рано, начиная с 22—23 нед. При любом сроке беременности могут отмечаться наиболее тяжелые проявления заболевания — общая водянка, отечная форма ГБП. Чаще же заболевание возникает в первые часы и дни после рождения. В зависимости от степени тяжести заболевание может проявляться в анемической, желтушной форме и форме универсального отека. При всех формах выражена анемия. При ГБП вследствие анемии, гипербилирубинемии, тканевой гипоксии, ацидоза нередко наблюдаются нарушения сердечной деятельности и состояния ЦНС. При ГБП беременность на всем протяжении может осложняться угрозой ее прерывания (поздний выкидыш, преждевременные роды). Диагностика основывается на выявлении ряда признаков, связанных с иммунизацией матери, развитием гипербилирубинемии, анемии и гипоксии плода. При определении тактики врача во время беременности, выборе способа и сроков родоразрешения, помимо выявления ГБП, очень важна оценка степени тяжести заболевания. Важным признаком является обнаружение антител в крови матери. Этот диагностический тест не является абсолютным, так как антитела не исчезают после их выработки в организме матери, даже если в последующем не развивается заболевание плода или если у плода резус-отрицательная кровь. Однако в комплексе с другими признаками наличие антител позволяет с некоторой долей вероятности предположить ГБП. Определенное значение имеет динамика титра антител. Титр антител отражает наибольшее разведение сыворотки крови (1:2, 1:4, 1:8, 1:16 и т.д.), при котором еще происходит гемолиз добавляемых к ней резус-положительных эритроцитов. Во время беременности титр антител может повышаться, несколько снижаться и колебаться. Нарастание титра антител не всегда определяется повышением степени иммунизации, иногда это объясняется попаданием их в кровяное русло из других клеток, а снижение — наоборот, связыванием их клетками. Тем не менее повышение титра антител, особенно значительное (на 3—4 порядка), учитывают как косвенный признак ухудшения течения ГБП. Гипербилирубинемия и анемия являются одними из основных признаков ГБП, поэтому чрезвычайно важно определение степени их выраженности, о чем с известной долей вероятности можно судить по оптической плотности билирубина (ОПБ) в околоплодных водах. ОПБ повышается по мере увеличения концентрации билирубина, экскретируемого почками плода. Околоплодные воды получают путем пункции передней стенки живота, матки, околоплодных оболочек (см. Амниоцентез). В околоплодных водах определяют ОПБ, титр антител, в случае необходимости — группу крови плода. При последнем амниоцентезе перед ро-доразрешением околоплодные воды исследуются на степень зрелости легких плода (пенный тест по методу Клеманса или определение соотношения содержания лецитина и сфингомиелина). ОПБ устанавливают с помощью спектрофотометрии при длине волны 450 нм по отношению к дистиллированной воде. При этом нормальная величина билирубинового пика, как правило, не превышает 0,1. При ОПБ от 0,1 до 0,15 можно предположить наличие ГБП легкой степени. В том случае, если ОПБ составляет от 0,15 до 0;2, можно ожидать рождение ребенка со средней и тяжелой формой гемолитической болезни. ОПБ от 0,2 и выше, как правило, свидетельствует о развитии у плода тяжелой формы ГБП либо его внутриутробной гибели. При оценке ОПБ могут быть получены ложноположительные результаты вследствие попадания в иглу крови матери (при производстве амниоцентеза), мекония, мочи или асцитической жидкости плода. ОПБ может быть снижена при разведении билирубина большим количеством околоплодных вод при многоводии, что нередко наблюдается при ГБП. Более точно оценить тяжесть гемолитического процесса можно при исследовании ОПБ амниотической жидкости при различных длинах волн света — от 300 до 700 нм. В таких случаях вычисляют ЛЕ, наносят на график, разделенный на 3 зоны в зависимости от степени тяжести гипербилируби-немии и срока гестации. От того, в какую зону попадает установленное значение ОПБ, зависит дальнейшая тактика врача. Важную роль в диагностике ГБП имеет УЗИ, которое целесообразно проводить в следующие сроки беременности: 20—22, 24— 26, 30—32, 34—36 нед и непосредственно перед родоразрешением. УЗИ позволяет выявить изменения как плаценты, так и плода. В зависимости от степени тяжести заболевания наблюдается увеличение толщины плаценты (в норме она зависит от срока гестации, составляя в III триместре в среднем 34—36 мм). Превышение нормальной для срока гестации толщины плаценты на 0,5—1,0 см и более указывает на возможное заболевание плода, в связи с чем требуется провести повторное УЗИ. При отечной форме ГБП толщина плаценты может достигать 60—80 мм. При гемолитической болезни УЗИ позволяет выявить у плода увеличение размеров печени и селезенки. Признаками отечной формы гемолитической болезни являются выраженная гепатоспленомегалия, асцит, многоводие. При выраженной водянке плода отмечаются, кроме того, кардиомегалия и перикардиальный выпот, гидроторакс, повышенная эхогенность кишечника вследствие отека его стенки, отек подкожной жировой клетчатки в области головы и конечностей плода. Дополнительными ультразвуковыми критериями оценки степени тяжести заболевания плода могут служить расширение вены пуповины (до 10 мм и более), повышенная скорость кровотока в нисходящей части аорты плода (скорость обратно пропорциональна содержанию гемоглобина у плода). В связи с тем что плод при ГБП переносит гипоксию, степень выраженности которой увеличивается по мере нарастания тяжести заболевания, важно получить информацию о его функциональном состоянии. С этой целью проводят определение биофизического профиля по видоизмененной шкале Vintzileos (1983). В отличие от маловодия, которое является неблагоприятным фактором у беременных без изосерологической несовместимости, при наличии таковой учитывают степень многоводия, а вместо степени зрелости плаценты — ее толщину. Остальные критерии шкалы (сердечная деятельность, дыхательные движения, двигательная активность, тонус) оцениваются по стандартной схеме (см. Дополнительные методы исследования. Определить наличие и степень тяжести ГБП возможно, проводя анализ крови плода, полученной из сосудов пуповины путем ее пункции (кордоцентез; см. Дополнительные методы исследования). Кордоцентез позволяет произвести непосредственное исследование пуповинной крови с определением группы крови и резус-принадлежности плода, уровня гемоглобина, билирубина, сывороточного белка и гематокрита, прямой пробы Кумбса. Наиболее важным критерием ГБП считают гематокрит (Ht), который, с одной стороны, свидетельствует о степени гемолиза, а с другой, является показателем компенсаторных возможностей гемопоэза. Снижение Ht на 10—15 % указывает на тяжелую форму ГБП (в норме Ht до 26 нед составляет 35 %, позднее — от 38 до 44 %). Ведение беременности и родовУ всех беременных при первом посещении врача определяют (или проверяют) группу и резус-принадлежность крови. У беременных с группой крови 0(1) в том случае, если у мужа иная группа, необходимо исследовать кровь на наличие групповых иммунных антител. У пациенток с резус-отрицательной кровью следует, начиная с ранних сроков, проводить анализ крови на наличие антител и определения их титра: до 20 нед беременности 1 раз в месяц, в последующем 1 раз в 2 нед. Для установления предполагаемой резус-принадлежности плода выявляют наличие резус-фактора у отца. Необходимо также проведение непрямой реакции Кумбса, которая позволяет определить, какие антитела циркулируют в крови, связанные или свободные. В отсутствие антител до 28 нед беременности многие исследователи рекомендуют беременным с резус-отрицательной кровью с профилактической целью внутримышечно вводить 300 мг Rh Ig, который может блокировать резус-антитела. Важно, чтобы препарат, содержащий антитела, не проходил через плаценту. Определение состояния плода на основании результатов оценки биофизического профиля и УЗИ проводят еженедельно, начиная с 31—32 нед. У беременных группы высокого риска развития ГБП (наличие в анамнезе у беременных с резус-отрицательной кровью поздних выкидышей, преждевременных родов, мертворождений, ГБН, переливания крови без учета Rh-принадлежности). УЗИ нужно проводить ежедневно или с интервалом 1—2 дня. С целью снижения сенсибилизации матери эритроцитами плода всем беременным с резус-отрицательной кровью даже в отсутствие у них резус-антител, а также при наличии АВО-сенсибилизации рекомендуется провести 3 курса неспецифической десенсибилизирующей терапии по 10—12 дней при сроке 10—12, 22—24, 32—34 нед. Женщины, у которых наблюдается осложненное течение беременности (угроза прерывания, токсикозы, гестозы), должны быть госпитализированы в отделение патологии беременных, где наряду с лечением основного заболевания проводят курс десенсибилизирующей терапии. Неспецифическая десенсибилизирующая терапия включает внутривенное введение 20 мл 40 % раствора глюкозы с 2 мл 5 % раствора аскорбиновой кислоты, 2 мл 1 % раствора сигетина и 100 мг кокарбоксилазы. Внутрь назначают рутин по 0,02 г 3 раза, теоникол по 0,15 г 3 раза или метионин по 0,25 г и кальция глюконат по 0,5 г 3 раза, препараты железа (ферроплекс по 1—2 драже 3 раза и др.), токоферола ацетат (витамин Е) по 1 капсуле. На ночь рекомендуется применять антигистаминные препараты (0,05 г димедрола, 0,025 г супрастина). Беременным, в анамнезе которых имеются самопроизвольные выкидыши и роды плодом с отечной или тяжелой желтушной формой гемолитической болезни, при высоком титре резус-антител в специализированном учреждении можно проводить плазмаферез, заключающийся в изъятии у беременных определенного объема (250—300 мл) плазмы, содержащей антитела, с помощью различных аппаратов (РК-0,5 «АМИНКО» и др.). Замещение изъятой плазмы производят коллоидными, кристаллоидными и белковыми препаратами и одновременно возвращают в кровоток форменные элементы крови беременной. Плазмаферез выполняют 1 раз в неделю под контролем титра антител, начиная с 23—24 нед беременности до родоразрешения; плазмаферез можно проводить и до беременности в качестве подготовки к ней. С целью уменьшения степени резус-сенсибилизации осуществляют гемосорбцию с использованием активированного угля для сорбции свободных антител (см. рис.). Применение гемосорбции оправдано у беременных с крайне отягощенным акушерским анамнезом (повторные выкидыши, рождение мертвого ребенка). Наиболее оптимальным сроком начала проведения гемосорбции считается 20—24 нед беременности. Гемосорбцию проводят в стационаре. За один сеанс гемосорбции через гемосорбент перфузируется 8—-12 л крови (2—3 ОЦК). Интервал между сеансами — 2 нед. Курс сорбционной терапии необходимо заканчивать за 1 нед до предполагаемого срока родоразрешения. Схема подключения устройства для проведения гемосорбции: 1 — катетеры, введенные в сосуды (в вену или в вену и артерию); 2 — трубчатая магистраль для забора крови; 3 — насос для прокачивания крови; 4 — пузырьковые камеры; 5 — устройство для подачи гепарина; 6 — манометры с делительными камерами, отделяющими их от непосредственного контакта с кровью; 7 — колонка с сорбентом; 8 — магнитный клапан для защиты пациента от воздушной эмболии; 9 — трубчатая магистраль для возврата крови. Стрелками показано направление движения крови по системе. В настоящее время широко проводят лечение ГБП путем внутриматочных гемотрансфузий под контролем ультразвука. Гемотрансфузии плоду можно проводить начиная с 18 нед беременности. Внутриутробное переливание крови создает предпосылки для пролонгирования беременности. Существуют внутрибрюшной и внутрисосудистый способы гемотрансфузии. Техника внутрибрюшной трансфузии заключается в проколе брюшной стенки матери, стенки матки, брюшной стенки плода и введении в его брюшную полость одногруппной и резус-отрицательной эритроцитной массы, которая адсорбируется лимфатической системой и достигает сосудистой системы плода. В последние годы предпочтение отдают внутрисосудистой гемотрансфузии плоду, показаниями к которой при резус-сенсибилизации являются выраженная анемия и гематокрит менее 30 %. С целью проведения внутрисосудистой гемотрансфузии выполняют кордоцентез, при этом вену пуповины пунктируют в непосредственной близости от ее вхождения в плаценту. Проводник извлекают из иглы и производят забор крови для определения предтрансфузионного гематокрита плода. Эритроцитную массу медленно вводят через иглу, после чего забирают вторую пробу крови для определения конечного плодового гематокрита и оценки адекватности проведенной терапии. Для остановки движений плода, вследствие которых игла может быть вытолкнута им из вены пуповины, плоду вводят ардуан (пипекуроний) внутривенно или внутримышечно. Определение необходимости и времени проведения последующих гемотрансфузий плоду основывается на результатах УЗИ, посттрансфузионных показателях гемоглобина и гематокрита у плода. Проведение амниоцентеза после внутриутробной трансфузии не имеет смысла, так как амниотическая жидкость после этой процедуры обычно окрашена кровью, что может привести к ложноположительным результатам определения оптической плотности. Эффективность лечения тяжелых форм ГБП с помощью внутрисосудистого переливания крови составляет 85—91 %, при внутрибрюшном — 66 %. Беременных, у которых отмечается резус-сенсибилизация, следует направлять в родильный дом при сроке беременности 34—36 нед, при АВ0-сенсибилизации — 36—37 нед для дополнительного обследования и решения вопроса о родоразрешении. При наличии ГБП необходимо досрочное родоразрешение, так как к концу беременности увеличивается поступление резус-антител к плоду. Оптимальные срок родоразрешения — 37—38 нед. беременности, так как при более раннем родоразрешении вследствие функциональной незрелости органов (особенно печени) гемолитическая болезнь протекает более тяжело, ребенок чаще страдает от респираторного дистресс-синдрома. Однако, если объективные данные свидетельствуют о выраженном страдании плода, если женщина имеет отягощенный акушерский анамнез, родоразрешение возможно и в более ранние сроки беременности. При этом необходимо провести мероприятия, направленные на ускорение созревания легких недоношенного плода. Назначают дексаметазон по 2 мг 4 раза в сутки за 2—3 дня до предполагаемых родов. При выраженной отечной форме ГБП беременность прерывают при любом сроке. Если к моменту родоразрешения при УЗИ определяют очень большие размеры живота плода, целесообразно выпустить асцитическую жидкость путем прокола передней брюшной стенки матери, матки и передней стенки живота плода. Как правило, родоразрешение проводят через естественные родовые пути. Кесарево сечение выполняют при наличии дополнительных акушерских осложнений (предлежание плаценты, неправильное положение плода, рубец на матке, выпадение пуповины и т.п.). Родовозбуждение нужно начинать с создания глюкозо-витаминно-гормонально-кальциевого фона в течение 2—3 дней (в зависимости от состояния шейки матки). При готовности шейки к родам производят амниотомию. В случае, если родовая деятельность не разовьется, через 5—6 ч после амниотомии начинают родовозбуждение окситоцином или простагландинами по общепринятой методике. В родах проводят тщательный контроль за состоянием плода, осуществляют профилактику гипоксии. Сразу после рождения ребенка его быстро отделяют от матери во избежание массивного попадания резус-антител в кровоток новорожденного. Из пуповины берут кровь для определения содержания билирубина, гемоглобина, группы крови ребенка, его резус-принадлежности. Проводят непрямую пробу Кумбса, позволяющую обнаружить эритроциты новорожденного, связанные с антителами (реакция агглютинации крови ребенка со специфической сывороткой Кумбса). Учитывая склонность плода и новорожденного с гемолитической болезнью к кровоизлияниям, следует бережно вести второй период родов. Целесообразны эпидуральная анестезия и рассечение промежности. При АВО-сенсибилизации ведение родов не имеет каких-либо особенностей. В последующем при необходимости заменного переливания крови новорожденным с гемолитической болезнью используют пуповинные сосуды, поэтому скобку на пуповину не накладывают. Пуповину перевязывают на расстоянии 2—3 см от пупочного кольца. Профилактика резус-сенсибилизации. Профилактические мероприятия заключаются в следующем: любое переливание крови производить с учетом резус-принадлежности крови реципиента и донора; необходимо сохранить первую беременность у женщин с резус-отрицательной кровью; профилактика и лечение осложнений беременности; проведение десенсибилизирующей терапии; осуществление специфической профилактики резус-сенсибилизации у женщин с резус-отрицательной кровью путем введения антирезус-иммуноглобулина после любого прерывания беременности. Иммуноглобулин-антирезус вводят по одной дозе внутримышечно однократно. Родильнице указанную дозу назначают в течение 48 ч после родов, а лучше — 24 ч, при аборте — по окончании операции. После кесарева сечения и ручного отделения плаценты дозу препарата необходимо удвоить. Важно произвести примерный расчет количества доз иммуноглобулина для родовспомогательных учреждений. Принимая во внимание данные литературы, следует считать, что из 1000 рожающих у 170 будет резус-отрицательная кровь. Из них у 100 женщин ребенок будет резус-положительным. Следовательно, на 1000 родов необходимо 100 доз препарата, если вводить его всем женщинам с резус-отрицательной кровью, родивших детей с резус-положительной кровью. При неукоснительном выполнении методики специфической профилактики резус-сенсибилизации можно практически решить проблему резус-конфликтной беременности. |
Министерства здравоохранения Республики Казахстан
Изосерологическая несовместимость крови матери и плода – гуморальный иммунный ответ резус – отрицательной матери на эритроцитарные антигены резус-положительного плода, при котором образуются антирезусные антитела. Эти антитела вызывают гемолиз эритроцитов, что приводит к гемолитической болезни плода и новорождённых [6].
I ВВОДНАЯ ЧАСТЬ.
Название протокола: Изосерологическая несовместимость крови матери и плода
Код протокола:
О36.0 Резус-иммунизация, требующая предоставления медицинской помощи матери.
Код(ы) МКБ-10:
O00–О99 Беременность, роды и послеродовый период
О30–О48 Медицинская помощь матери в связи с состоянием плода, амниотической полости и возможными трудностями родоразрешения
O36 Медицинская помощь матери при других установленных или предполагаемых патологических состояниях плода.
О36.0 Резус-иммунизация, требующая предоставления медицинской помощи матери.
О36.1 Другие формы иммунизации, требующие предоставления медицинской помощи матери.
Сокращения, используемые в протоколе:
HBSAg – поверхностный антиген вируса гепатита B, «австралийский» антиген).
HCV TOTAL – антитела к антигенам вируса гепатита C.
Ig – иммуноглобулин.
RHD – резус D.
АВ0 – система групп крови человека.
АД – артериальное давление.
АЛаТ – аланинаминотрансфераза.
АсАТ – аспартатаминотрансфераза
ВИЧ – вирус иммунодефицита человека.
ВПК – внутриутробное переливание крови.
ВСМП – высокоспециализированная медицинская помощь.ГБП – гемолитическая болезнь плода.
ГБПиН – гемолитическая болезнь плода и новорожденного.
ГБПН – гемолитическая болезнь новорожденного.
ИПД – инвазивная пренатальная диагностика.
КТГ – кардиотокография.
ЛДГ – лактатдегидрогеназа.
МоМ – английская аббревиатура термина “multiple of median”, отражает степень отклонения показателя от среднего значения (медианы).
МППК – маточно – плодово – плацентарный кровоток.
Нt – гематокрит.
Нв – гемоглобин.
ОАК – общий анализ крови.
ОАМ – общий анализ крови.
СМА – средне – мозговая артерия.
УЗИ – ультразвуковое исследование.
ФМТ – фето – материнская трансфузия.
ЭКГ – электрокардиограмма.
Дата разработки протокола: 2014 год.
Категория пациентов: Беременные, роженицы и родильницы с резус отрицательной принадлежностью крови.
I группа риска: Беременные с резус отрицательной принадлежностью крови без титра антител.
II группа риска: Беременные с резус отрицательной принадлежностью крови с титром антител без признаков ГБП.
III группа риска: Беременные с резус отрицательной принадлежностью крови с титром антител с признаками ГБП.Пользователи протокола: акушеры-гинекологи.
Достоверность доказательств: [2]
Классификация уровней доказательности | Классы рекомендаций А Систематический обзор рандомизированных контролируемых исследований или совокупность доказательств, состоящих, в основном, из исследований, оцененных как 1+ непосредственно применимых к целевой группе населения и демонстрирующих однородность результатов В С Совокупность доказательств, включая исследования, оцененные как 2+, непосредственно применимые к целевой группе населения и демонстрирующие однородность результатов; или Экстраполированные доказательства из исследований, оцененные как 2++D Уровень доказательности 3 или 4; или Экстраполированные доказательства из исследований, оцененные как 2+ Хорошая практика
|
У всех людей кровь красного цвета. Делают ее такой красные кровяные тельца – эритроциты.
Но, несмотря на одинаковый цвет, она разная. И такой ее делают те же эритроциты. Из-за этого возникают конфликты крови, поскольку у разных ее видов при смешивании наблюдается несовместимость. Такое негативное взаимодействие встречается и при беременности.
Почему отличается кровь у людей?
Существует десятки различных систем, каждая из которых по своему описывает отличия в крови разных людей. Наиболее популярны из них система АВО и резус-система.
Система АВО
На клеточной мембране эритроцита находятся антигены А и В. В плазме крови, в которой находятся эритроциты, присутствуют агглютинины (антитела) α и β. В итоге возможны четыре комбинации антител и антигенов. Каждое из этих сочетаний и определяет группу крови человека.
- Если присутствует комбинация, включающая в себя α и β, кровь у человека первой группы или нулевой – 0 (I).
- Сочетание А и β дает вторую группу – A (II).
- Третья группа образуется, когда присутствуют В и α – В (III).
- Четвертая группа получается из сочетания А и В – АВ (IV).
Почему возможны только эти комбинации? Потому что одноименные антитела и антигены, например, В и β не могут находиться в крови человека. Они вступают в контакт другом с другом, что приводит к гибели эритроцитов.
Резус-система
Резусом в координатах этой системы является антиген D (белок), расположенный на клеточной мембране эритроцита. У людей, которые имеют этот белок, кровь является резус-положительной. Ее принято обозначать Rh+. Когда белок отсутствует – статус резус-отрицательный (Rh-).
Как ребенок наследует кровь
Система АВО
Существует распространенное заблуждение, что у ребенка будет либо группа крови матери, либо отца. Публикуются таблицы, с помощью которых якобы можно на основании групп отца и матери узнать группу ребенка. Однако они описывают не закономерность, а вероятность. На самом деле может получиться любая группа.
Резус-система
Точный прогноз возможен, только когда оба родителя резус-отрицательные. У ребенка будет резус-отрицательный статус. В остальных случаях резус может быть и с плюсом, и с минусом.
Два вида конфликта
Резус-конфликт по группе крови возможен при беременности, только когда у матери кровь Rh-. Сколько на свете людей с отрицательным резус-фактором? Намного меньше, чем резус-положительных (европейцы – 15%, африканцы – 7%, азиаты – 1%). Поэтому конфликты по причине разного резус-фактора встречаются не часто.
Конфликт группы крови матери и ребенка – явление опасное. Однако надо отметить, что резус- конфликт имеет более тяжелые последствия для ребенка, чем конфликт группы крови.
Конфликт по группе крови при беременности (таблица)
Конфликт при четвертой группе крови при беременности, как показывает таблица, невозможен, когда ее имеет будущая мама. Во всех остальных случаях конфликт вероятен. Несовместимость по группе крови у матери и ребенка наиболее сильно проявляется, когда женщины с первой группой вынашивает плод со второй или третьей группой.
| мать | ребенок |
| 0(I) | A(II) |
| 0(I) | B(III) |
| 0(I) | AB(IV) |
| A(II) | B(III) |
| A(II) | AB(IV) |
| B(III) | A(II) |
| B(III) | AB(IV) |
Как действует конфликт по группе крови матери и ребенка?
При поступлении крови плода в кровь матери, ее организм начинает реагировать на обнаруженный чужой антиген, то есть на тот, что имеется у ребенка, но не у матери. Реакция заключается в том, что начинают вырабатываться антитела по группе крови при беременности, призванные уничтожить чужой антиген и тем самым обезопасить организм матери.
Материнские антитела попадают в кровь плода и приступают к разрушению эритроцитов. Нехватка эритроцитов оборачивается кислородным голоданием для ребенка. При гибели эритроцитов образуются токсины. Эти факторы негативно воздействуют на организм плода и дают начало гемолитической болезни.
Когда происходит конфликт по группе крови
Он возможен при самой беременности, во время родов и при грудном вскармливании ребенка.
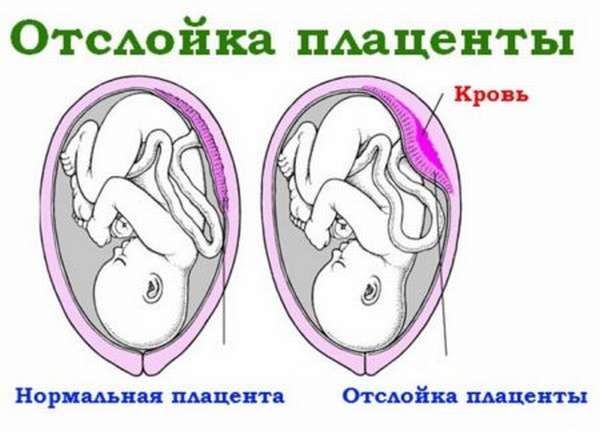
Во время вынашивания ребенка
Если беременность протекает нормально, смешивания крови матери и ребенка не происходит, поскольку существует плацентарный барьер. Суть этого барьера заключается в том, что здоровая плацента обладает свойствами пропускать одни вещества от матери к ребенку, а другие нет.
Но иногда кровь смешивается, и возникает конфликт по группе крови при беременности. Такое происходит, например, при отслойке плаценты.
Симптомы отслойки плаценты выглядят так:
- кровотечение из половых путей,
- напряженное состояние матки и боль ее пальпации,
- нарушение работы сердца ребенка.
Опасность для здоровья малыша зависит от степени патологии. Если отслаивается от одной трети до половины плаценты, ребенок погибает. При малейшем подозрении на отслойку плаценты беременной женщине следует немедленно обратиться к врачу.
Наиболее значимый конфликт по группе возникает на ранних этапах беременности. Длительное выделение антител наносит ребенку больший ущерб, чем когда это происходит на поздних сроках или при родах.
При родах
Во время родов происходит естественное разрушение плаценты, кровь матери и ребенка вступает в контакт.
- Риск нежелательных осложнений в виде гемолитической болезни невысок, если роды происходят по нормальному сценарию.
- Однако если они принимают затяжной характер, через определенный промежуток времени у новорожденного может развиться гемолитическая болезнь.
Если рожает женщина с первой группой или с отрицательным резус-фактором, обязательно берется кровь на анализ из вены пуповины, чтобы узнать группу ребенка, его резусный статус и уровень билирубина.
Высокий уровень билирубина показывает, что идет усиленное разрушение эритроцитов в крови малыша. Если показатель билирубина не соответствует норме, в процессе лечения проводятся повторные анализы.
При кормлении
Современная медицина считает, что гемолитическая болезнь может появиться при кормлении ребенка грудью в очень редких случаях, так как материнские антитела гибнут в желудке ребенка. Но еще лет двадцать назад матерям с первой группой или с отрицательным резус-фактором запрещалось несколько дней кормить своих детей. Врачи полагали, что в течение этого времени прекращается выработка антител организмом матери.
Какие факторы увеличивают риск конфликта
Самый низкий уровень риска наблюдается, когда женщина рожает в первый раз.
- Угроза конфликта повышается, если женщина подвергалась процедуре переливания крови.
- Аборты или выкидыши тоже относятся к негативным факторам.
- Еще один фактор – вторая, третья и последующие беременности.
- Если женщина уже рожала, и дети имели различного рода проблемы со здоровьем, например, фиксировалась гемолитическая болезнь новорожденных, отклонения в психике, то имеется серьезная угроза конфликта по группе.
Как можно узнать о конфликте заранее
Если зачатие не носит случайный характер, перед ним желательно узнать совместимость группи резус-факторы, которые имеют потенциальные мама и папа. Анализы можно сдать в государственных медицинских учреждениях и частных клиниках, например в сети «Инвитро». Требования по подготовке к тесту на группу и резус-фактор несколько разнятся.
- При определении группы рекомендуют не есть четыре часа перед началом анализа.
- К подготовке на тест по резус-фактору требования жестче. В частности, запрещается принимать жирную пищу за сутки до взятия пробы и не курить полчаса до этого.
Можно сдавать сразу два анализа. Кровь берут либо из пальца, либо из вены.
Зная группу и резус-факторы обоих родителей, можно с определенной степенью точности определить рискованные сочетания.
Информацию по рискам можно получить из следующей таблицы.
| мать | отец |
| 0 (I) | A(II), B (III), AB(IV) |
| A(II) | B(III), AB(IV) |
| B(III) | A (II), AB (IV) |
Однако стоит обратить внимание на относительную достоверность этих комбинаций. Они говорят о том, риск конфликта по группе вероятен, но не обязателен.
Профилактические меры
Конфликт между матерью и плодом по группам крови опасен тем, что женщина может о нем не догадываться. Его наличие не ухудшает ее самочувствие. Поэтому нужно контролировать уровень антител (титр) в ней.
Стандартное расписание анализов выглядит следующим образом:
- до 32 недели – один раз в месяц:
- с 32 по 36 неделю два раза в месяц,
- после этого срока – каждую неделю.
Однако при отклонениях от нормы приходится сдавать анализы чаще, если же титр определяется высокий, то беременную женщины положат в стационар на тщательное обследование.
- Оно включает в себя ультразвуковое исследование (УЗИ) плаценты, околоплодных вод, состояния печени и селезенки плода. Избыточное количество околоплодных вод, аномально увеличенные печень и селезенка малыша, утолщенная плацента свидетельствуют о развитии конфликта по группе крови, резус-фактору.
- В определенных ситуациях, когда сохранность плода вызывает опасения у врачей, может быть проведена процедура под названием амниоцентез (анализ околоплодных вод). Высокая плотность околоплодных вод свидетельствует о процессе разрушения эритроцитов. Амниоцентез позволяет точно определить группу крови малыша и количество антител.
- Еще одна процедура – кордоцентез. При ней берется на анализ кровь из пуповины. Делается процедура с помощью иглы, которая вводится в матку через прокол в передней брюшной стенке. Этот анализ позволяет оценить, с какой тяжестью протекает гемолитическая болезнь.
- При наличии конфликта по резус-фактору делается прививка резусного иммуноглобулина.
Терапия при конфликте
Что может входить в курс лечения?
- Выполняется внутривенное введение витаминов, глюкозы. Назначаются уколы иммуноглобулина.
- Чтобы уменьшить количество антител у беременных женщин, может применяться плазмаферез. Во время проведения этой процедуры производится забор крови из вены (250-300 мл). Затем клеточную массу отделяют от плазмы, разбавляют специальными растворами и возвращают обратно в вену.
Первый недостаток плазмафереза в том, что за одну процедуру удаляется не более пятой части вредных веществ, поэтому приходится делать несколько сеансов.
Второй минус заключается в том, что вместе с антителами и другими нежелательными компонентами удаляются полезные вещества (иммуноглобулины, фибриноген, протромбин).
Плазмаферез противопоказан при плохой свертываемости крови и низком содержании белков.
- Когда идет повышение титра, также используют метод очистки, известный как гемосорбция. Кровь в этом случае очищается сорбентами, задерживающими токсические примеси, включая антитела.
Что надо знать о гемолитической болезни
Если, несмотря на все принятые меры, ребенок родился с ней, родителям не стоит впадать в панику.
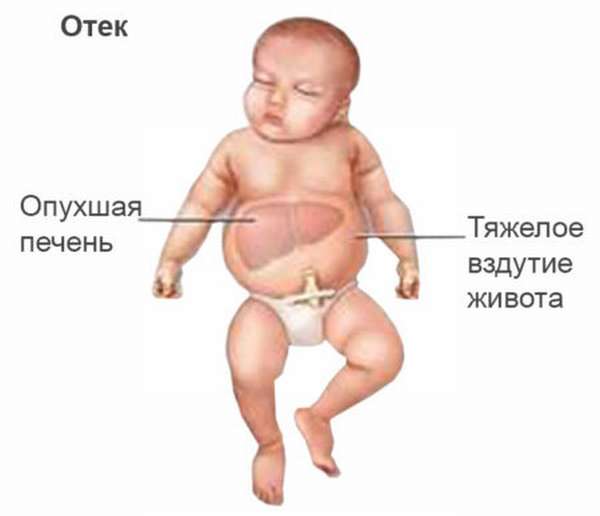
Клинические формы
Различают три формы этой патологии:
- отечная,
- желтушная,
- анемичная.
- Первая форма встречает редко, но имеет самые тяжелые последствия. Называется так, потому что ребенок рождается в очень плохом состоянии, с выраженными отеками и тяжелой формой анемии.
- При второй форме заболевания повышенное содержание билирубина в крови младенца придает ей желтый цвет (желтуха новорожденных), какой наблюдается, например, при гепатите А.
- Легче всего болезнь протекает при анемичной форме. Внешних признаков нет, или они слабо выражены, диагностируется при лабораторном анализе крови.
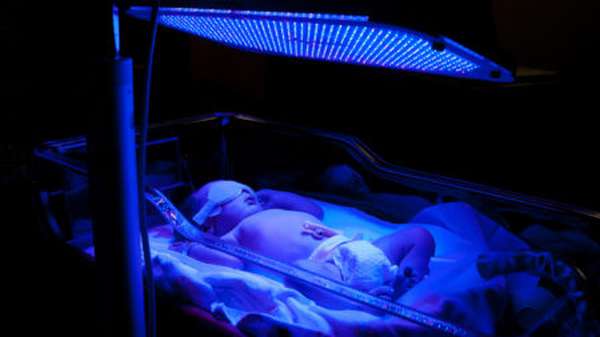
Лечение
- При тяжелой форме практикуется заменное переливание крови, гемосорбция и плазмаферез.
- Если заболевание у новорожденного протекает в легкой форме (или после терапии тяжелой формы) назначают внутривенные вливания белков, глюкозы. Прописываются лекарства и витамины, улучшающие работу печени. Применяется терапия белым или синим светом, чтобы окислить непрямой билирубин в коже новорожденного.
Что ждет малыша? Его будущее зависит от тяжести патологии. При адекватной терапии прогноз в основном позитивный.
Дополнительную информацию по теме можно получить из видео:
Больше о гемолитической болезни новорожденных можно узнать из видео:
Резус-несовместимость возникает, когда беременная женщина, чья группа крови резус-отрицательна, подвергается резус-положительной крови из своего плода, что приводит к выработке у матери антител к резус. Эти антитела могут проникать через плаценту и прикрепляться к эритроцитам плода, что приводит к гемолизу или разрушению эритроцитов плода. Это приводит к тому, что плод становится анемичным, что может привести к гемолитической болезни новорожденного.В тяжелых случаях для исправления анемии может потребоваться внутриутробное переливание крови для плода.
Первый случай, связанный с Rh-несовместимостью, был зарегистрирован в 1939 году, хотя резус-фактор, белок, обнаруженный на поверхности эритроцитов, еще не был обнаружен. Об этом первом случае сообщил иммуногематолог Филип Левайн и врач Руфус Стетсон, опубликовавший свой случай в The Journal of American Medical Association . Авторы представили анонимную двадцатипятилетнюю женщину, которая в течение своей тридцать третьей недели беременности обратилась в местную больницу с жалобами на боли в родах и влагалищное кровотечение.На следующий день она родила истощенного мертворожденного плода весом всего один фунт и пять унций. Врачам пришлось изгнать плаценту женщины, чтобы остановить ее от кровотечения до смерти. Пациентка получила переливание крови от своего мужа, поскольку у них была группа крови О. Через десять минут после завершения переливания у пациентки начался озноб и она почувствовала боль в голове и ногах. Когда ее влагалищное кровотечение возобновилось, ей сделали гистерэктомию с последующим переливанием крови от другого донора.На протяжении всего ее визита пациентка получала переливания от 104 доноров крови типа О. Примечательно, что мать не показала реакции переливания крови у двадцати одного из этих доноров. Дальнейшие исследования показали, что сыворотка пациента или плазма в крови за вычетом факторов свертывания крови специфически агглютинировали клетки ее доноров, или, точнее, 80 процентов всех ее переливаний крови.
Два врача пытались выяснить, что вызывает реакцию пациента. Первоначально они полагали, что температура влияет на агглютинацию в крови пациента, но вскоре они поняли, что температура не влияет на агглютинацию.Врачи сообщили, что было трудно воссоздать эти агглютинации для дальнейшего тестирования, так как они еще не решили, что является причиной этих изоиммунизаций или развития антител в ответ на антигенную стимуляцию.
Лишь через год Карл Ландштайнер и Александр С. Винер придумали термин «резус-фактор» как причину изоиммунизации. Первоначально они полагали, что Macacus rhesus , или макака-резус, содержали такой же антиген на поверхности эритроцитов (Rh), который обнаружен в эритроцитах человека.Вскоре это было доказано неверно, так как состав сывороток человека и резус различен. Тем не менее, термин «резус-фактор» продолжает использоваться для описания этих человеческих антигенов, а термин «анти-резус» используется для описания человеческих антител, образованных против резус-фактора.
Наиболее распространенная форма резус-несовместимости возникает, когда резус-отрицательная мать и резус-положительный отец производят резус-положительный плод. Однако ситуация не становится опасной, пока не произойдет утечка из кровообращения плода в кровообращение матери.Как только в кровь матери попадает значительное количество резус-положительной крови, начинается процесс, известный как аллоиммунизация эритроцитов. Это первичное воздействие резус-положительной крови в материнское кровообращение приводит к сенсибилизации, которая приводит к материнской продукции резус-положительных антител, называемых резус-иммуноглобином G (IgG). Материнские IgG-антитела могут проходить через плаценту и атаковать эритроциты плода внутри плода, поскольку они признаны чужеродными.
Эффект аллоиммунизации эритроцитов на плод известен как гемолитическая болезнь новорожденного, которую иногда называют резус-болезнью.Когда происходит аллоиммунизация эритроцитов, антитела IgG высвобождаются в материнскую циркуляцию, а резус-позитивные эритроциты плода связываются, образуя комплексы антиген-антитело. Эти комплексы инициируются для разрушения, что приводит к аллоиммунной гемолитической анемии. Хотя система Rh группы крови состоит из нескольких антигенов (то есть D, C, c, E, e) — антиген Rh D составляет большинство всех случаев, связанных с несовместимостью Rh, поскольку он является наиболее иммуногенным. Когда эритроциты разрушаются, они производят билирубин, который вызывает желтуху у ребенка.
В большинстве случаев сенсибилизация происходит во время родов, и даже в этом случае резус-положительные перворожденные дети обычно не страдают. Процесс сенсибилизации тренирует организм реагировать на будущие антигены; в этом случае резус-фактор присутствует в эритроцитах плода. После сенсибилизации матери требуется время для выработки резус-антител против крови плода и ее антител для уравновешивания в кровообращении плода. Из-за процесса сенсибилизации сенсибилизация матери, как правило, не затрагивает перворожденных, если она не была сенсибилизирована в результате предыдущего выкидыша или аборта.Если мать не была сенсибилизирована перед родами, мать не вырабатывает достаточного ответа антител IgG во время родов, оставляя первенца без повреждений.
Риск и серьезность сенсибилизирующего ответа увеличивается с каждой последующей беременностью с резус-положительным плодом. Без лечения у женщин с усиленным эффектом резус-несовместимости может появиться умеренно анемичный второй ребенок. Последующие роды, однако, могут привести к гибели плода из-за тяжелой вызванной антителами гемолитической анемии.Эта наиболее экстремальная форма резус-несовместимости произошла в первом сообщенном случае агглютинации в 1939 году.
Профилактика остается лучшим средством лечения резус-несовместимости. Поскольку антитело Rh IgG, или RhoGAM, впервые было выпущено в 1968 году, оно оказалось чрезвычайно успешным в снижении Rh-несовместимости. Введение (инъекция) этого антитела первоначально упоминалось как «большой D» в кругах банков крови и было сделано из плазмы других резус-положительных матерей, которые родили резус-положительного ребенка.Сообщалось, что женщины, которые обычно имели высокую концентрацию «большого D», зарабатывали до 80 000 долларов в год на продажу своей плазмы. Тем не менее, коммерческое производство этого антитела снизило риск несовместимости Rh с 10 до 20 процентов до менее чем 1 процента. Антитело вводят всякий раз, когда существует вероятность попадания резус-позитивных клеток плода в материнское кровообращение резус-негативной матери. Когда указано, это обычно управляется в 28 — 32 недели беременности и снова в течение 72 часов после родов.Результаты угрожающего или самопроизвольного выкидыша, амниоцентеза или ворсин хориона могут также указывать на необходимость применения RhoGAM.
Точный механизм работы RhoGAM до сих пор неизвестен, и он используется только для предотвращения резус-заболевания. После того, как у матери произошла сенсибилизация, RhoGAM не сможет предотвратить прогрессирование заболевания. После рождения больного ребенка агрессивная гидратация и фототерапия с использованием билирубиновых ламп могут использоваться в качестве средства против желтухи.В тяжелых случаях может потребоваться внутриутробное переливание крови, пока плод остается в матке. Чтобы исправить анемию плода, эта процедура включает в себя иглу, направленную в пуповину под ультразвуковым контролем. Переливание происходит каждые две-три недели до конца беременности.
Источники
- Адвент, Нил и Мэрион Рид. «Система резус-группы крови: обзор», Blood 95 (2000): 375–87.
- Додд, Дж.M., Windrim, R.C., van Kamp, I.L. «Методы внутриутробного переливания плода женщинам с эритроцитарной изоиммунизацией для улучшения результатов в отношении здоровья (обзор)», The Cochrane Collaboration (2010).
- Ли, Кимберли и Дэвид Зив. «Резус-несовместимость», MD Consult (2009). http://www.mdconsult.com.ezproxy1.lib.asu.edu/das/patient/body/238755736-5/1142260880/10041/31860.html (по состоянию на 1 ноября 2010 г.).
- Левин, Филипп, Ньюарк, Н.J и Стетсон, Руфус. «Необычный случай внутригрупповой агглютинации», Журнал Американской медицинской ассоциации (1939): 126–27.
- Старр, Дуглас. «Кровь: эпическая история медицины и коммерции». В Кровавый бум , 210–11. Нью-Йорк: Издательство Harper Collins, 2002.
Антониос, Натали, «Резус-несовместимость при беременности».
(2011-04-08). ISSN: 1940-5030 http://embryo.asu.edu/handle/10776/2073.
Университет штата Аризона. Школа наук о жизни. Центр биологии и общества. Энциклопедия проекта эмбрионов.
© Аризонский совет регентов, лицензированный как Creative Commons Attribution-NonCommercial-Share Alike 3.0 Unported (CC BY-NC-SA 3.0) http://creativecommons.org/licenses/by-nc-sa/3.0/
.Кровь человека: Rh Типы крови
Rh Типы крови
Rh
группы крови были открыты в 1940 году Карлом
Ландштейнер и Александр Винер. Это было
40 лет спустя
Ландштейнер обнаружил группы крови АВО. За последнюю половину
века, мы узнали гораздо больше о процессах, ответственных за резус
типы. это
группа крови может быть самой сложной генетически из всех систем крови, так как она включает 45
различные антигены на поверхности эритроцитов, которые контролируются 2
тесно связанные гены на хромосоме 1.
Резус система была названа в честь резус обезьяны, так как они были первоначально использованы в исследовании, чтобы сделать антисыворотку для типирования образцов крови. Если антисыворотка агглютинирует ваши эритроциты, вы Rh + , Если это не так, вы Rh- , Несмотря на его фактическую генетическую сложность, наследование этой черты обычно можно предсказать простым концептуальная модель, в которой есть два аллеля, D и д. Лица, которые являются гомозиготными доминантными (DD) или гетерозиготный (дд) Rh +. Те, кто гомозиготный рецессивный (дд) Rh- (т.е. они не имеют ключа Rh антигены).
Клинически резус-фактор, как и АВО-факторы, может привести к серьезным медицинские осложнения. Самая большая проблема с группой Rh не так много несовместимость следующие переливания (хотя они могут происходить) как переливания между матерью и ее развитием плод. мать-плод несовместимость возникает, когда мать Rh- (дд) и ее плод Rh + (DD или Dd). Материнские антитела могут проникать через плаценту и разрушать эритроциты плода. Риск увеличивается с каждой беременностью. европейцы чаще всего имеют эту проблему — 13% их новорожденных детей находятся в риск. Фактически только об этих детях (6% всех европейских рождений) есть осложнения. При профилактическом лечении это число можно сократить еще больше. Менее 1% из тех, кого лечат, имеют проблемы. Тем не менее, несовместимость резус-группы крови по-прежнему является основной причиной потенциально смертельного исхода. связанные с кровью проблемы новорожденного. В Соединенных Штатах 1 из 1000 детей рождаются с этим условием.
Rh Тип мать-плод несовместимость возникает только тогда, когда Rh + мужчина отцом ребенка с Rh- матерью. Поскольку отец Rh + может иметь DD или Дд генотип, возможны 2 комбинации спаривания с различными рисками, как показано ниже. Независимо от генотипа отца, если он Rh +, а мать Rh-, врачи предполагают, что возникнет проблема несовместимости, и действуют соответственно.
| |
Человеческий плод у матери
матка |
Имейте в виду, что только Rh + дети (Dd), вероятно, имеют медицинские осложнения.когда и мать, и ее плод Rh- (dd), роды будут нормальными.
первый Когда женщина Rh забеременеет, обычно нет проблем с несовместимостью для нее резус + плод. Тем не менее, вторые и последующие роды, скорее всего, опасно для жизни проблемы для резус + плод. Риск увеличивается с каждым рождением. В чтобы понять, почему первенцы обычно в безопасности, а потом дети нет, необходимо понимать некоторые функции плаценты.Это это орган, который соединяет плод со стенкой матки через пуповина. Питательные вещества и антитела матери регулярно передаются через плацентарный барьер в плод, но ее эритроциты, как правило, нет (за исключением случая случайного разрыв). Как правило, анти-Rh + антитела не существуют у матери-новичка если она ранее не вступала в контакт с Rh + кровью. Поэтому ее антитела вряд ли агглютинируют эритроциты ее резус + плода.плацентарный разрывы происходят обычно при рождении, так что кровь матери попадает в материнскую кровь система, стимулирующая выработку антител к резус-антигенам крови. Всего одна капля крови плода стимулирует производство большого количества антител. Когда наступает следующая беременность, происходит передача антител от матери Система снова происходит через плацентарную границу в плод. Вырабатываемые ею анти-резус-антитела реагируют с кровью плода, вызывая многие его эритроциты разрываются или агглютинируют.В результате новорожденный ребенок может иметь опасную для жизни анемию из-за отсутствия кислорода в крови. Ребенок также обычно желтушен, лихорадит, довольно опухший, имеет увеличенную печень и селезенку. Это состояние называется эритробластоз плода , Стандартное лечение в тяжелых случаях — немедленное массивное переливание резус-крови ребенку с одновременным истощением существующего кровь вымывает резус-антитела от матери.Обычно это делается сразу после рождение, но это может быть сделано для плода до рождения. Потому что ребенок собственные Rh + красные кровяные клетки были заменены на Rh-, матери-анти-Rh + антитела не агглютинируют любые дополнительные эритроциты. Позже, резус кровь будет заменена естественным путем, так как ребенок постепенно вырабатывает собственный Rh + кровь. Любые остаточные анти-Rh + антитела от матери оставят постепенно, потому что ребенок не производит их.
Эритробластоз Для женщин с высоким риском можно предотвратить развитие плода (то есть, Rh- женщины с Rh + помощниками или помощниками, чья кровь тип неизвестен) сыворотка (Ро-Гам ) содержащие анти-Rh + антитела в мать около 28-й недели беременность и снова в течение 72 часов после рождения ребенка с Rh +. это должно быть сделано для первой и всех последующих беременностей. Инъецированные антитела быстро агглютинируют любые эритроциты плода, когда они попадают в кровь матери, тем самым мешая ей формируя ее собственные антитела.Сыворотка обеспечивает только пассивную форму иммунизация и скоро покинет ее кровь поток. Следовательно, она не производит никаких длительных антител. Это лечение может быть на 99% эффективным в предотвращении эритробластоза плода,. Rho-GAM также обычно предоставляется Rh-women после выкидыш, внематочная беременность или искусственный аборт. Без использования Rho-GAM женщина Rh, вероятно, произведет большие количества Rh + антител каждый раз, когда она становится беременной с ребенком Rh +, потому что она может вступить в контакт с большим количеством Rh + крови.Следовательно, риск опасный для жизни эритробластоз Плод увеличивается с каждой последующей беременностью.
Anti-Rh + антитела могут продуцироваться у человека с резус-кровью в результате получает несоответствующее переливание крови. Когда это происходит, есть Вероятно, будет продуцирование антител на протяжении всей жизни. Еще раз, Rho-GAM может предотвратить это.
Мать-плод Проблемы несовместимости могут также возникнуть с системой ABO. Тем не менее, они очень редки — менее 0,1% родов страдают и обычно симптомы не такие сильные. Чаще всего это происходит, когда мать типа O, а ее плод A, B или AB. Симптомы у новорожденного у детей обычно желтуха, легкая анемия и повышенная уровень билирубина. Эти проблемы у ребенка обычно успешно лечатся без переливания крови.
ПРИМЕЧАНИЕ. кто-то, будучи Rh + или Rh-, является упрощением.Много вариации резус-групп крови в зависимости от того, какие из 45 резус-антигенов настоящее время. Наиболее важные из этих антигенов для матери-плода проблемы несовместимости и переливания, по-видимому, представляют собой D, C, c, E и e. Когда человек идентифицируется как Rh + или Rh-, он обычно находится в ссылка на антиген D. Другими словами, индивидуум — это RhD + или RhD-.
,
Rh Несовместимость Patraporn Kinorn
Справочная информация • Резус-фактор (т.е. резус-фактор) является антигеном поверхности красных кровяных клеток, который был назван в честь обезьян в который был впервые обнаружен.
Резус-несовместимость, также известная как резус-заболевание, представляет собой состояние , которое возникает, когда женщина с резус-отрицательным типом крови подвергается резус-положительным клеткам крови, что приводит к развитию резус-антител
Резус-несовместимость может возникнуть двумя основными механизмами. • Наиболее распространенный тип возникает, когда резус-отрицательная беременная мать подвергается резус-положительным эритроцитам плода • вторично по отношению к кровотечению из матки во время беременности в результате самопроизвольного или искусственного аборта, травмы, инвазивных акушерских процедур или родов.
Резус-несовместимость может также возникнуть, когда резус-отрицательная женщина получает переливание крови, которая содержит резус-антигены. Частично это является причиной того, что банки крови предпочитают использовать тип крови «O-отрицательный» или «тип O, резус-отрицательный» в качестве универсального типа донора, особенно у женщин.
Наиболее частая причина несовместимости резус-фактора это воздействие на резус-отрицательную мать резус-положительной кровью плода во время беременности или родов, в результате чего эритроциты из кровообращения плода проникают в материнское кровообращение.После значительного воздействия происходит сенсибилизация и вырабатываются материнские антитела против чужеродного резус-антигена.
После производства материнские резус-иммуноглобулиновые G (IgG) антитела могут свободно переходить из плаценты в кровообращение плода, где они образуют комплексы антиген-антитело с резус-позитивными эритроцитами плода и в конечном итоге разрушаются, что приводит к плоду аллоиммунная гемолитическая анемия. Хотя системы группы крови Rh состоят из нескольких антигенов (например, D, C, C, E, E), антиген D является наиболее иммуногенным; следовательно, он чаще всего связан с Rh-несовместимостью.
Патофизиология • Количество крови плода, необходимое для получения резус-несовместимости, варьируется. В одном исследовании было показано, что менее 1 мл резус-положительной крови сенсибилизирует добровольцев резус-отрицательной кровью. И наоборот, другие исследования показали, что у 30% людей с резус-отрицательной кровью никогда не развивается резус-несовместимость, даже если им бросают вызов с большими объемами резус-положительной крови.
Таким образом, на большинство перворожденных с резус-положительным типом крови это не влияет, поскольку короткий период от первого воздействия резус-положительных эритроцитов плода до рождения ребенка недостаточен для получения значительного ответа материнского IgG-антитела.
Риск и серьезность сенсибилизирующего ответа увеличивается с каждой последующей беременностью с участием плода с резус-положительной кровью.
У женщин, склонных к резус-несовместимости, вторая беременность с резус-положительным плодом часто приводит к умеренно анемичному младенцу, тогда как на последующих беременностях рождаются более серьезно пораженные дети, которые в конечном итоге могут умереть в утробе матери от массивных антител, индуцированных гемолитическая анемия
Риск сенсибилизации в значительной степени зависит от следующих 3 факторов: • Объем трансплацентарного кровоизлияния • Степень материнского иммунного ответа • Одновременное наличие несовместимости АВО
Раса • Приблизительно 15-20-20-20 белых, в отличие от 5-10% афроамериканцев, имеют резус-отрицательную группу крови.• Среди лиц китайского и американского происхождения происхождение резус-отрицательной группы крови составляет менее 5%.
История • История предшествующего переливания крови • резус-группа крови матери • резус-группа крови отца (55% резус-положительных мужчин являются генетически гетерозиготными по резус-антигену и, следовательно, продуцируют резус-отрицательные потомство при спаривании с резус-отрицательными женщинами в 50% случаев.)
Предыдущие беременности, включая самопроизвольные и плановые аборты • Предыдущее введение резус-IgG • Механизм травмы в случаях травмы • Наличие вагинального кровотечения и / или амниотические выделения • Предыдущие инвазивные акушерские процедуры, такие как амниоцентез, кордоцентез, забор ворсинок амниона или внематочная беременность. травмы.Таким образом, оправдан высокий индекс подозрений, и указан низкий порог для лечения
Физический • Для обеспечения стабильности у матери указана оценка показателей жизнедеятельности и первичное обследование дыхательных путей и сердечно-сосудистой системы. • Требуется тщательное обследование таза. • В ситуациях, когда необходимо рассмотреть травму живота и / или таза, проверьте наличие синяков, которые могут указывать на возможность значительного кровоизлияния в матку.
Когда младенец с резус-отрицательной матерью рождается в году ЭД, после начальной стабилизации необходимо провести тщательный физический осмотр младенца и немедленно проконсультироваться с неонатологом. • Физические данные могут варьировать от легкой желтухи до крайней бледности и анемии с фетальным отеком.
Причины • Факторы, которые влияют на то, может ли у резус-отрицательной беременной женщины развиваться резус-несовместимость, включают следующее: • Внематочная беременность • Предлежание плаценты • Отслойка плаценты • Травма живота / таза • Смертность плода • Все инвазивные акушерская процедура (например, амниоцентез) • Отсутствие дородовой уход • Спонтанный аборт
Другие проблемы, которые будут рассматриваться ABO incompatibilityAutoimmune гемолитическая anemiaMicroangiopathic гемолитическая anemiaSpherocytosisHereditary фермент deficienciesAlpha thalassemiaChronic fetomaternal hemorrhageTwin-близнец transfusionErythroblastosis fetalisHydrops плода,
Лабораторные исследования • Пренатальная неотложная помощь. • Определение резус-группы крови требуется у каждой беременной женщины.
У беременной женщины с резус-отрицательным типом крови скрининг-тест Rosette часто является первым выполненным тестом. Тест Rosette может обнаружить аллоиммунизацию, вызванную кровоизлияниями в матку всего 4-7 эритроцитов. При наличии большого клинического подозрения на большое кровоизлияние в матку (> 30 мл эритроцитов) часто проводят тест на элюцию кислотой Клейхауэра-Бетке. Тест Kleihauer-Betke представляет собой количественное измерение эритроцитов плода в материнской крови и может быть полезным для определения необходимости введения дополнительных количеств резус-IgG.Количество резус-IgG, необходимое для лечения, составляет не менее 20 мкг / мл у эритроцитов плода.
Получение титров материнских резус-антител может быть полезным для последующего последующего ухода за беременными женщинами, которые, как известно, являются резус-негативными и могут быть инициированы с помощью ЭД. • Высокий уровень материнских резус-антител свидетельствует о том, что резус-сенсибилизация произошла, и для оценки состояния здоровья плода могут потребоваться дальнейшие исследования, такие как амниоцентез и / или кордоцентез.
Неотложная послеродовая помощь • Сразу же после рождения любого ребенка с резус-отрицательной матерью в ED или на догоспитальном этапе исследуют кровь из пуповины младенца на предмет группы крови ABO и типа резус, измеряют гематокрит и уровень гемоглобина, выполнить анализ билирубина сыворотки, получить мазок крови и выполнить прямой тест Кумбса.
Положительный результат прямого теста Кумбса подтверждает диагноз индуцированной антителами гемолитической анемии, что свидетельствует о наличии резус-несовместимости. • Повышенные измерения билирубина в сыворотке крови, низкий гематокрит и повышенное количество ретикулоцитов у новорожденного могут помочь определить, необходимо ли раннее обменное переливание крови. • Неонатологу, специализирующемуся на этой процедуре, требуется срочное обменное переливание крови у детей, рожденных с эритробластозом плода, водянкой плода или ядерной желтухой.
Исследования по визуализации: • В ED исследования ультразвукового исследования беременной женщины с подозрением на резус. несовместимость ограничена ультразвуком органов малого таза.• Асцит плода и отек мягких тканей — явные признаки серьезного поражения. • После развития гидропс плода, сонографические данные включают отек кожи головы, кардиомегалию, гепатомегалию, выпот в плевральной полости и асцит. Аномальные тоны сердца плода и ультразвуковое свидетельство повреждения плода или плаценты являются признаками ухудшения состояния плода, требующего неотложной доставки, в идеале в центре, специализирующемся на акушерской помощи высокого риска.
Prehospital Care • По возможности персонал догоспитальной помощи должен направить свои усилия на стабилизацию состояния матери и ребенка с последующей немедленной доставкой в учреждение, специализирующееся на акушерской и неонатальной помощи высокого риска.
Отделение неотложной помощи: • ЭД лечение беременной женщины с резус-отрицательной кровью и подозрением на кровоизлияние в матку варьируется в зависимости от предлежания пациента и гестационного возраста плода.• Когда младенец с резус-несовместимостью доставляется в ЭД, требуется более агрессивный подход, основанный на дыхательной и гемодинамической стабилизации младенца и определяющий необходимость неотложного обменного переливания и фототерапии неонатологом.
Получите резус-статус беременной женщины. • Если у матери резус-отрицательная кровь и ранее она не сенсибилизировалась, введите анти-D иммуноглобулин человека (резус-IgG) и направьте женщину к акушеру для дальнейшей оценки.
Если мать была сенсибилизирована ранее, как определено повышенными Rh-антителами матери, то введение Rh IgG не имеет значения. В этой ситуации необходимо незамедлительное направление в центр, специализирующийся на акушерстве высокого риска.
Rh IgG, впервые выпущенный для общего использования в 1968 году, был удивительно успешным в предотвращении резус-несовместимости. У резус-отрицательной матери препарат вводят после подозрения на кровоизлияние в матку.Точный механизм, с помощью которого пассивное введение Rh IgG предотвращает резус-иммунизацию, неизвестен. Наиболее вероятная гипотеза состоит в том, что резус-иммуноглобулин покрывает фетальные эритроциты, содержащие резус-антигены на своей поверхности. Эти экзогенные комплексы антитело-антиген проникают через плаценту, прежде чем они могут стимулировать В-клетки эндогенной иммунной системы матери к выработке антител IgG.
Поскольку Rh IgG стал стандартом лечения в США, риск несовместимости резус-фактора был снижен от 10-20% до менее 1%.Из-за своего короткого периода полувыведения резус-IgG обычно вводится один раз на 28-32 неделе беременности и снова в течение 72 часов после рождения всем резус-отрицательным беременным женщинам в рамках обычной дородовой помощи.
В настоящее время рекомендуется, чтобы каждая резус-отрицательная неиммунизированная женщина, которая предъявляет к ЭД кровотечение перед родами или потенциальное кровоизлияние в матку, должна получать 300 мкг резус-IgG IM. На каждые 30 мл цельной крови плода, подвергаемой материнскому кровообращению, следует вводить 300 мкг резус-IgG.Препарат Rh IgG с более низкой дозой 50 мкг доступен и рекомендуется для резус-отрицательных женщин, у которых прерывание беременности в первом триместре, когда считается, что кровоизлияние в матку минимально
ตาราง
Уход: • После введения резус-IgG в ЭД незамедлительно направьте резус-отрицательную беременную маму с резус-положительным плодом к акушеру в учреждении, оборудованном для акушерской помощи высокого риска.
Сдерживание / профилактика • Подчеркните важность раннего дородового ухода для каждой беременной женщины, предъявляющей ЭД. Раннее назначение резус-IgG в сочетании с ранним дородовым уходом является лучшим средством предотвращения резус-несовместимости.
Осложнения: • Срочная доставка ребенка, родившегося с hydrops fetalis, должна быть как можно более нетравматичной. В идеале, неонатолог, который готов выполнить обменное переливание крови, должен немедленно оказать помощь ребенку.
конец
