Бифидумбактерин Форте инструкция по применению: показания, противопоказания, побочное действие – описание Bifidumbacterin Forte капс. 50 млн.КОЕ (5 доз): банки 10, 18 или 30 шт. (18724)
Препарат принимают внутрь во время приема пищи, при необходимости — независимо от приема пищи.
Препарат в форме капсул назначают взрослым и детям в возрасте 3 лет и старше. Капсулы принимают, запивая кипяченой водой или кисломолочным продуктом. Для детей при необходимости капсулы вскрывают, и смешивают ее содержимое с жидкой пищей, предпочтительно с кисломолочным продуктом. Содержимое капсулы можно смешать с 20-50 мл кипяченой воды комнатной температуры, при этом образуется мутная взвесь с частичками сорбента черного цвета. Полученную водную взвесь следует выпить, не добиваясь полного растворения.
Препарат в форме порошка для приема внутрь назначают взрослым и детям всех возрастных групп. Порошок перед употреблением смешивают с жидкой пищей, предпочтительно с кисломолочным продуктом, для новорожденных и грудных детей — с материнским молоком или смесью для искусственного вскармливания.
В зависимости от тяжести заболеваний Бифидумбактерин форте применяют в обычных или увеличенных дозах.
С целью лечения препарат в обычных дозах назначают пациентам всех возрастных групп.
Обычная доза для взрослых составляет по 2 капсулы или по 2 пакетика 2-3 раза/сут; для детей в возрасте 3 лет и старше — по 1 капсуле 3-4 раза/сут, в возрасте 1 года и старше — по 1 пакетику 3-4 раза/сут, в возрасте до 1 года — по 1 пакетику 2-3 раза/сут.
Курс лечения при острых кишечных инфекциях и пищевых токсикоинфекциях составляет 5-7 дней, при других заболеваниях — 15-21 день, в зависимости от характера и тяжести заболевания. При необходимости курсы лечения можно повторить 2-3 раза, каждый курс проводится через месяц после окончания предыдущего курса лечения.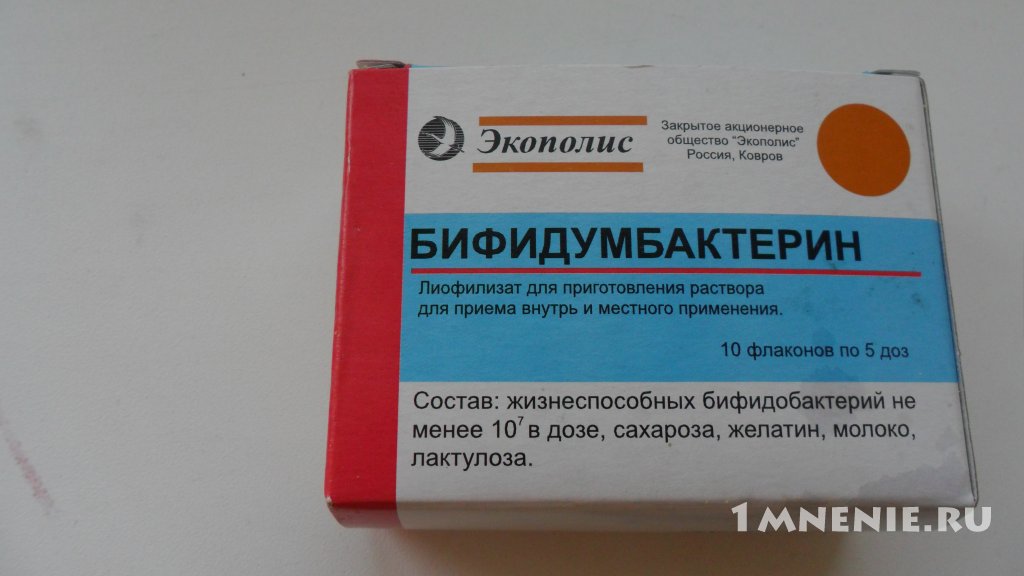
При хирургической патологии препарат применяют в течение 3-5 дней до операции и в течение 10-15 дней после операции: взрослым назначают по 2 капсулы или по 2 пакетика 3 раза/сут; детям в возрасте 3 лет и старше — по 1 капсуле 3-4 раза/сут, в возрасте 1 года и старше — по 1 пакетику 3-4 раза/сут, в возрасте до 1 года — по 1 пакетику 3 раза/сут.
С целью лечения препарат в увеличенных дозах назначают взрослым и детям в возрасте 1 года и старше.
При острой кишечной инфекции и острой респираторной вирусной инфекции препарат назначают с первых суток заболевания: взрослым — по 10 капсул или по 10 пакетиков 3 раза/сут; детям в возрасте 3 лет и старше
При хронических заболеваниях ЖКТ назначают взрослым по 10 капсул или 10 пакетиков 1-3 раза/сут; детям в возрасте 3 лет и старше — по 5 капсул 1-3 раза/сут, в возрасте 1 года и старше — по 5 пакетиков 1-3 раза/сут.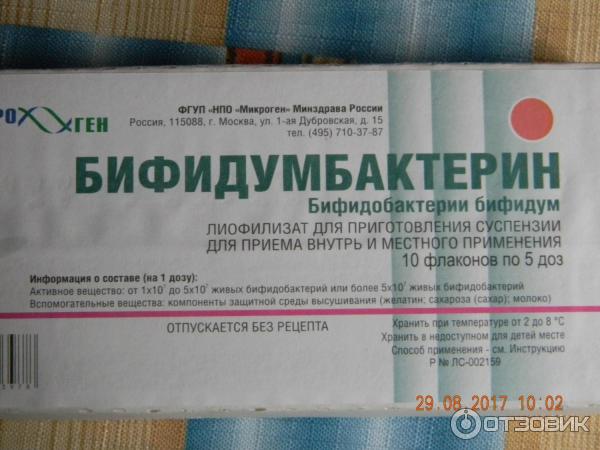 Курс лечения составляет 10-14 дней.
Курс лечения составляет 10-14 дней.
При применении у детей капсулы рекомендуется вскрывать и смешивать их содержимое с 50 мл кипяченой воды комнатной температуры.
С целью профилактики Бифидумбактерин форте назначают взрослым и детям старше 3 лет по 1-2 капсулы или по 1-2 пакетика 1-2 раза/сут; детям в возрасте до 1 года — по 1 пакетику 1 раз/сут. Профилактический курс составляет 10-15 дней 2-3 раза/год. Для профилактики внутрибольничных инфекций в родильных домах и больницах препарат применяют 5-10 дней.
«Как принимать Бифидумбактерин?» – Яндекс.Кью
Бифидумбактерин — препарат, содержащий живые бифидобактерии. Препарат способствует нормализации микрофлоры кишечника, влагалища, нормализует функционирование ЖКТ.
Согласно инструкции, способ и дозы применения препарата:
- сухой Бифидумбактерин. Взрослые пациенты, которые страдают дисбактериозом, должны принимать по 5 доз средства внутрь трижды в день.
 Порошок, как правило, принимается от 2 недель до 3 месяцев. Для профилактики развития дисбактериоза по 5 доз 1-2 раза в сутки нужно принимать на протяжении 1-2 недель. Для детей, которые от рождения входят в группу риска с точки зрения развития дисбактериоза кишечника, внутрь нужно принимать по 1-2 дозы трижды ежесуточно. После полугода суточная доза увеличивается до 3 доз. Средство нужно давать детям сразу перед началом кормления. После годовалого возраста дети получают по 5 доз 2 или 3 раза в сутки. Если необходима профилактика дисбактериоза детям, болеющим пневмонией, сепсисом и др., в сутки следует принимать по 2-3 дозы средства. Если у ребенка отмечается нарушения функционирования ЖКТ, угроза проявления энтероколита, в сутки нужно принимать 10 доз.
Порошок, как правило, принимается от 2 недель до 3 месяцев. Для профилактики развития дисбактериоза по 5 доз 1-2 раза в сутки нужно принимать на протяжении 1-2 недель. Для детей, которые от рождения входят в группу риска с точки зрения развития дисбактериоза кишечника, внутрь нужно принимать по 1-2 дозы трижды ежесуточно. После полугода суточная доза увеличивается до 3 доз. Средство нужно давать детям сразу перед началом кормления. После годовалого возраста дети получают по 5 доз 2 или 3 раза в сутки. Если необходима профилактика дисбактериоза детям, болеющим пневмонией, сепсисом и др., в сутки следует принимать по 2-3 дозы средства. Если у ребенка отмечается нарушения функционирования ЖКТ, угроза проявления энтероколита, в сутки нужно принимать 10 доз. - Бифидумбактерин в ампулах. Схемы приема аналогичны с бифидумбактерином сухим, так как ампулы препарата содержат каждая по 5 доз.
- Микроген Бифидумбактерин сухой, который содержится в пакете, нужно высыпать в емкость и добавить в него воду (5 мл на 1 дозу).
 Далее средство перемешивается около 10 минут. Растворенный препарат хранить нельзя, оставшуюся нерастворенную часть можно хранить не более одного дня.
Далее средство перемешивается около 10 минут. Растворенный препарат хранить нельзя, оставшуюся нерастворенную часть можно хранить не более одного дня. - жидкий Бифидумбактерин, инструкция по применению свидетельствует, что его можно использовать как внутрь, так и местно. Концентрат препарата расфасован во флаконах. Жидкий Бифидумбактерин применяется с целью профилактики мастита. В этом случае нужно обработать сосок и область около него. Для этого используется ватный тампон, обработка проводится за полчаса до начала кормления. Процедуру нужно проводить 5 дней, при этом каждый раз используется 2-2,5 дозы. При поражениях кожи средство наносится на места поражений. Внутрь нужно применять жидкий препарат в следующей суточной дозировке: взрослые могут принимать 3–5 мл, дети первого года жизни — 1 мл, дети до 3 лет — 1–2 мл, дети до 7 лет — 2–3 мл. Следует учесть, что 1 мл средства — это 20 капель. Жидкий препарат также вводится в виде микроклизмы ректально. Для этого 3–5 мл средства нужно развести в 50 мл воды.
 При вагинальном применении на поверхность тампона, который пропитан водой или физиологическим раствором, наносится 3–5 мл концентрата. Такой тампон должен находиться во влагалище 4–8 часов.
При вагинальном применении на поверхность тампона, который пропитан водой или физиологическим раствором, наносится 3–5 мл концентрата. Такой тампон должен находиться во влагалище 4–8 часов. - свечи Бифидумбактерин, инструкция по применению предусматривает ректальное введение по 1-2 суппозитория один или два раза в сутки при кишечных болезнях. Лечение продолжается от 7 до 30 дней. При гинекологических болезнях вагинально выводится по 1 суппозиторию дважды в сутки на протяжении 5-10 дней.
- Бифидумбактерин в капсулах назначается взрослым пациентам и детям от 3 лет. В детском возрасте нужно принимать по 1 капсуле 3 или 4 раза в сутки. Взрослые люди принимают по 2 капсулы 2 или 3 раза в сутки. При некоторых заболеваниях (острые инфекции) назначается детям по 3-5 капсул, при этом таблетки в такой дозе нужно принимать до 6 раз в день. Взрослые люди при острых инфекциях принимают по 10 таблеток трижды в день. Терапия длится до 14 дней.

Точная схема лечения определяется лечащим врачом индивидуально.
противопоказания, побочное действие, дозировки, состав – в справочнике лекарственных средств
Бифидумбактерин сухой при кишечных заболеваниях применяют перорально, а в акушерско-гинекологической практике интравагинально.
С флакона удаляют металлический колпачок и резиновую пробку. Содержимое флакона растворяют кипяченой водой комнатной температуры из расчета 1 чайная ложка на 1 дозу лекарственного средства.
Способ растворения:
- в стакан наливают требуемое количество чайных ложек воды (в соответствии с числом доз, указанных на этикетке тары), затем из стакана переносят во флакон небольшое количество воды для растворения сухой массы. После растворения содержимое флакона переносят в тот же стакан и перемешивают.
Одна чайная ложка растворенного таким образом лекарственного средства составляет одну дозу. Необходимое количество доз (соответственно чайных ложек) выпивают за 20-30 мин до еды.
При кишечных заболеваниях длительность курса лечения бифидумбактерином определяется тяжестью клинических проявлений, возрастом больного и составляет 2-4 недели, а в отдельных случаях до 3-х месяцев. С профилактической целью назначают по 5 доз 1-2 раза/сут в течение 1-2 недель.
Новорожденным группы «риска» целесообразно начинать применение лекарственного средства в родильном отделении с первых суток жизни до выписки по 1-2 дозы на прием 3 раза/сут.
При кишечных заболеваниях детям первого полугодия жизни лекарственное средство назначают по 3 дозы на прием 3 раза/сут. Детям второго полугодия и старше — по 5 доз 2 раза/сут.
При возникновении у детей нарушений функций ЖКТ и угрозы язвенно-некротического энтероколита назначают до 10 доз в сут.
При острых хронических воспалительных заболеваниях тонкого и толстого кишечника, колитах и энтероколитах у взрослых рекомендуется по 5 доз 2-3 раза/сут.
В комплексной терапии с антибиотиками и другими антибактериальными препаратами рекомендуется:
- детям до 1 года по 5 доз 2-3 раза/сут, детям старше 1 года по 5 доз 3-4 раза/сут, взрослым по 10 доз 2-3 раза/сут.
Для интравагинального введения бифидумбактерин растворяют выше указанным способом. Полученной взвесью лекарственного средства пропитывают стерильный тампон, который вводят интравагинально и оставляют на 2-3 ч.
При воспалительных гинекологических заболеваниях и предродовой подготовке беременных группы «риска» бифидумбактерин назначают по 5-10 доз 1 раз/сут в течение 5-8 дней под контролем восстановления чистоты вагинального секрета до I-II степени и исчезновения клинических симптомов воспаления. При необходимости курс лечения бифидумбактерином можно повторить.
инструкция по применению, аналоги, состав, показания
Бифидумбактерин применяется как вспомогательное средство для симптоматического лечения диареи и в качестве дополнения к восполнению потери жидкости и/или диетическим мерам у взрослых и детей.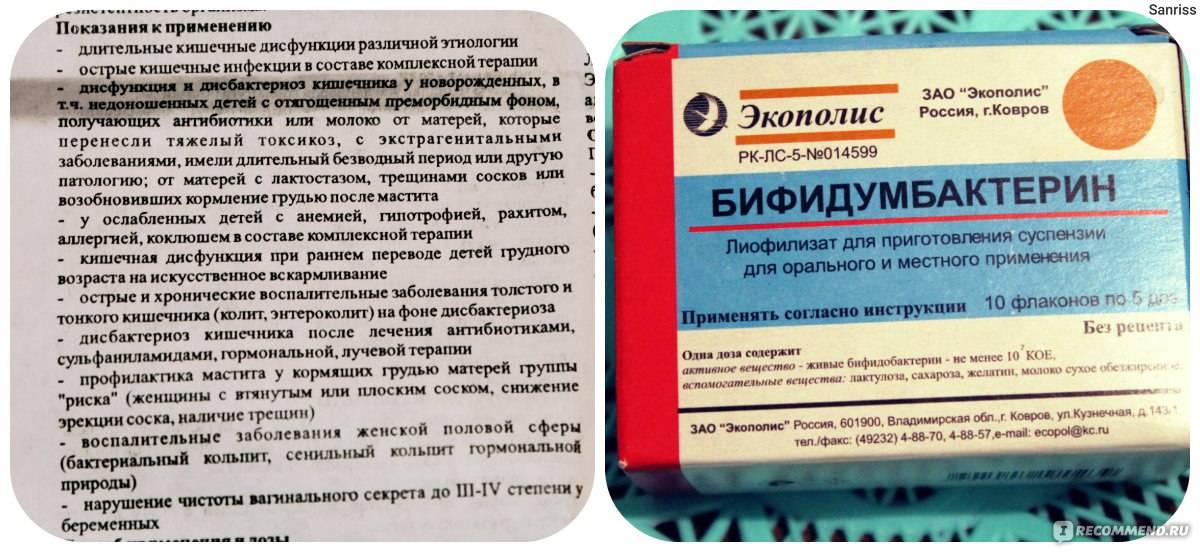
Детям (в том числе недоношенным) лекарственное средство можно применять с первых дней жизни.
Бифидумбактерин применяют для восстановления микробиологического равновесия в кишечнике:
при острых и хронических воспалительных заболеваниях толстого и тонкого кишечника у детей и взрослых, протекающих на фоне нарушений микрофлоры с дефицитом бифидобактерии;
при кишечных дисфункциях после антибактериальной и лучевой терапии;
в комплексной терапии больных острыми кишечными инфекциями бактериальной и вирусной природы, реконвалесцентов с симптомами кишечной дисфункции, для профилактики расстройств функции кишечника при антибактериальной терапии детей с гнойно-воспалительными заболеваниями;
для профилактики кишечных дисфункций у недоношенных детей, а также у детей в период новорожденности при раннем переводе на искусственное вскармливание.
Бифидумбактерин применяют в гинекологической практике для нормализации влагалищного микробиоценоза в комплексной терапии кольпитов, в том числе у беременных женщин.
Противопоказания для применения
Врожденная недостаточность лактазы. Нарушение всасывания глюкозы-галактозы.
Меры предосторожности при применении
Не следует принимать Бифидумбактерин одновременно с алкоголем, чтобы избежать снижения терапевтической эффективности препарата.
Особенностей применения в геронтологической практике не выявлено.
Необходимо проконсультироваться с лечащим врачом перед приемом Бифидумбактерина, если у Вас:
температура тела выше 38 °C,
острая боль в животе,
следы крови или слизи в стуле,
диарея длится более двух дней и сопровождается сильными болями в животе, обезвоживанием и потерей веса,
хронические заболевания: сахарный диабет, СПИД.
При ухудшении состояния, появлении новых симптомов или жалоб необходимо обращаться к врачу.
С осторожностью применять лицам с непереносимостью лактозы.
Недопустимо растворение препарата в горячей воде (выше 40 °C) и хранение его в растворенном виде.
Взаимодействие с другими лекарственными препаратами
При одновременном приеме Бифидумбактерина с витаминами (особенно группы В) действие препарата усиливается. При приеме антибиотиков рекомендованный интервал между приемом антибиотика и препарата Бифидумбактерин составляет 3–4 часа.Возможность применения препарата в периоды беременности и грудного вскармливания
Препарат разрешен для применения женщинам в периоды беременности и грудного вскармливания. Особых условий приема нет.
Возможность применения препарата лицами с нарушением функции печени и почек
Нарушение функций печени и почек не является противопоказанием для применения препарата, так как механизм его действия не связан с процессом всасывания в системный кровоток.
Не выявлено особенностей применения лекарственного препарата у лиц с нарушением функции печени и почек.
Влияние препарата на способность управлять транспортными средствами, механизмами
Препарат не влияет на способность управлять транспортными средствами и работать с опасными механизмами.
Бифидумбактерин для Новорожденных (и Грудничков!)
Опытные мамы и папы уверяют, что Бифидумбактерин для новорожденных и грудничков является эффективным и проверенным средством в борьбе с коликами и вздутием живота. Безопасно ли это средство, и как давать Бифидумбактерин грудничку?
Содержание:
Работа желудочно-кишечного тракта у младенца
Чем полезен Бифидумбактерин детям
В какой форме давать Бифидумбактерин грудничкам
Бифидумбактерин или Бифидумбактерин Форте для новорожденных — что лучше?
Бифидумбактерин: инструкция для новорожденных
Сухой Бифидумбактерин — как разводить?
Противопоказания
Кишечник едва родившегося младенца – это воплощение чистоты, совершенная медицинская стерильность. В нем пока не содержатся ни «плохие», ни «хорошие» бактерии, помогающие переваривать пищу. Первые микроорганизмы ребенок получает только с материнским молоком, но зачастую их оказывается недостаточно.
В нем пока не содержатся ни «плохие», ни «хорошие» бактерии, помогающие переваривать пищу. Первые микроорганизмы ребенок получает только с материнским молоком, но зачастую их оказывается недостаточно.
Когда бактерий в организме слишком мало, организм не успевает справляться с поступающей в него пищей, и у малыша начинаются проблемы с работой ЖКТ, появляются колики и дисбактериоз.
В этом случае бифидобактерии для новорожденных становятся средством спасения. Это микроскопические живые организмы, идентичные бактериям, которые содержатся в кишечнике человека – попадая в организм младенца, они налаживают работу желудочно-кишечного тракта. Давайте разберемся, как они работают и зачем нужны?
Работа желудочно-кишечного тракта у младенца
Значимость правильной работы пищеварительной системы в целом и кишечника в частности невозможно переоценить. Большинство питательных веществ усваивается именно там – поэтому, когда кишечник работает неправильно, и организму не хватает энергии, плохое настроение, слабость и недомогания обеспечены.
Не обошло это стороной и новорожденных – для едва родившихся малышей правильная работа ЖКТ важна ничуть не меньше, чем для взрослых! При малейших сбоях в его работе у младенца появятся вздутия и колики, что доставляет много беспокойства и ему, и его родителям.
Работа желудочно-кишечного тракта строится на взаимодействии бактерий. Поступая в организм с молоком матери, полезные бактерии формируют колонии и защищают место своего обитания от незваных гостей: они обволакивают кишечник защитной пленкой, способствующей правильной работе кишечника, и помогают формировать нервные окончания для приема иной пищи, кроме молока или детской смеси.
Однако, когда полезных бактерий в организме оказывается недостаточно, у малыша начинаются спазматические колики. Поступившая в организм пища не успевает перерабатываться целиком, начинает бродить и выделять газовые пузырьки, вызывая болезненную реакцию.
Важно, чтобы бактерий в кишечнике ребенка было достаточно: малейшая их нехватка приведет к спазмам, авитаминозу, дисбактериозу и другим неприятным состояниям, которые придется лечить.
Деятельность желудочно-кишечного тракта отражается на всем организме маленького человека, поэтому правильная его работа – залог здоровья вашего малыша. И, когда полезных бактерий в нем оказывается недостаточно, Бифидумбактерин для новорожденных и грудничков – первый помощник. В качестве активного компонента препарата выступает бифидобактерия бифидум.
Чем полезен Бифидумбактерин детям
Этот замечательный препарат с бифидобактериями в основе станет настоящим спасением для малыша, имеющего проблемы с пищеварительной системой. Живые микроорганизмы в его составе, идентичны полезным бактериям в кишечнике человека, при попадании в организм начнут выполнять их функцию: застилать кишечник защитной пленкой, развивать нервные окончания для усваивания полезных веществ, бороться с болезнетворными микроорганизмами.
Препарат Бифидумбактерин быстро устранит большинство проблем, возникающих в ЖКТ малютки: дисбактериоз, колики, нехватку питательных веществ, способную даже привести к рахиту.
Не менее полезно будет назначение такого препарата малышам с анемией и диатезом, а также детям, переходящим на новое питание: к примеру, с грудного молока на детскую смесь.
Однако важно отметить, что бактерии бифидум для новорожденных и грудничков не стоит использовать в качестве профилактики: препарат назначает исключительно педиатр при серьезных отклонениях в работе желудочно-кишечного тракта, когда неправильная работа микроорганизмов становится причиной болезней и недомогания.
Назначать Бифидумбактерин для детей самостоятельно нельзя!
Если у вашего малыша все в порядке с полезными бактериями, а вы станете давать ему препарат, то это может спровоцировать дисбактериоз именно их перенасыщением.
Бифидумбактерин, помимо бифидобактерий в составе, может также оказывать антибактериальное воздействие на болезнетворные бактерии. Таким образом, этот препарат не только нормализует работу желудочно-кишечного тракта, а еще и восстанавливает иммунитет.
В какой форме давать Бифидумбактерин грудничкам
Препарат выпускается в нескольких разных формах:
- сухой Бифидумбактерин – порошок во флаконах и фольгированных пакетиках;
- жидкий Бифидумбактерин в ампулах;
- в капсулах;
- в таблетках;
- свечи Бифидумбактерин.
Для новорожденных и грудных детей рекомендуется использовать препарат Бифидумбактерин детский, произведенный в жидком виде, а так же в виде порошков или свечей.
Бифидумбактерин или Бифидумбактерин Форте для новорожденных — что лучше?
Бифидумбактерин Форте считается улучшенным лекарственным препаратом.
Он отличается биомассой живых бифидобактерий, адсорбированных на косточковом активированном угле. Это позволяет препарату, попав в кишечник, действовать быстрее.
Поэтому, несомненно, при серьезных заболеваниях лучше использовать Бифидумбактерин форте.
Бифидумбактерин: инструкция для новорожденных
Конечно же, Бифидумбактерин новорожденным и грудничкам должен назначаться сугубо индивидуально, в зависимости от того, в каком состоянии сейчас находится пищеварительная система младенца: за этим должен следить педиатр. Его же задача назначать подходящую схему приема.
В зависимости от состояния ребенка врач может назначить от 2 до 5 доз 1-3 раза в сутки. Длительность курса – до 21 дня, возможен повтор через 1 месяц.
Родителям следует знать, что в таблетке и свече содержится по 1 дозе препарата, остальные формы препарата содержат по 5 доз.
Желательно принимать лекарство за полчаса до еды, либо спустя 1 час после. То есть препарат для достижения максимальной эффективности нужно пить на пустой желудок. В случае с младенцами добиться этого достаточно сложно. Поэтому допустимо разводить Бифидумбактерин для новорожденных молоком. Грудничкам, находящимся на искусственном вскармливании, порошок Бифидумбактерин можно добавлять и разводить вместе с порошковыми смесями.
Грудничкам, находящимся на искусственном вскармливании, порошок Бифидумбактерин можно добавлять и разводить вместе с порошковыми смесями.
Сухой Бифидумбактерин — как разводить?
Порошок следует высыпать в небольшую емкость, затем добавить кипяченую воду из расчета 5 мл на 1 дозу (один пакетик содержит 5 доз). Средство необходимо тщательно перемешать, выждать около 10 минут для максимального растворения (препарат полностью не растворяется).
Приготовленный раствор хранению не подлежит (бифидобактерии в нем быстро погибают), а вот оставшуюся нерастворенной часть порошка можно хранить, но не более суток.
Противопоказания
Бифидумбактерин для грудничков и новорожденных в допустимых инструкциях дозах совершенно не опасен, поскольку не имеет никаких побочных действий и противопоказаний. Но есть оно «НО!». Возможна аллергическая реакция на один из компонентов препарата.
Если у вашего малыша есть непереносимость какого-либо из следующих веществ, воздержитесь от приема и проконсультируйтесь о замене препарата с педиатром:
- лактоза;
- крахмал высушенный;
- стеарат кальция.
Если вы не знали об аллергии у своего малыша на указанные компоненты, но обнаружили у него усиленное вздутие или колики после приема, иные проявления аллергической реакции, прекратите применение Бифидумбактерина немедленно. Существуют аналоги этого препарата, не содержащие в составе этих веществ – можете попробовать принимать их.
Правильная работа желудочно-кишечного тракта младенца – это очень важно. Если не помогать ребенку вовремя, страдания в младенческом возрасте могут обратиться проблемами с пищеварением во взрослом: поэтому, если вашему ребенку не хватает полезных бактерий, смело применяйте Бифидумбактерин, но предварительно проконсультируйтесь со специалистом.
Как принимать Бифидумбактерин
Как разводить бифибумбактерин для новорожденных?
Как известно, иногда новорожденным потребуется «помощь» в виде полезных бактерий для пищеварительной системы, если их желудочно-кишечный тракт был заселен условно-патогенной флорой. В результате этого малыш часто плачет, срыгивает, происходит вздутие живота, ребенка мучает газообразование и колики. В некоторых случаях врачи назначают такой эффективный препарат, как бифидумбактерин, который содержит живые бифидобактерии, являющиеся в норме частью микрофлоры желудка. Но для многих неопытных мам совсем непонятно, как разводить бифидумбактерин для новорожденных. Постараемся помочь!
Бифидумбактерин — способ применения для новорожденных
Вообще, этот лекарственный препарат можно найти в нескольких формах: сухой и жидкой. Первая форма выпускается в виде таблеток и порошка в пакетиках, ампулах, флаконах. Правда, для младенцев разрешен только порошок. Бифидумбактерин жидкий для новорожденных выпускается во флаконах.
Первая форма выпускается в виде таблеток и порошка в пакетиках, ампулах, флаконах. Правда, для младенцев разрешен только порошок. Бифидумбактерин жидкий для новорожденных выпускается во флаконах.
Как давать бифидумбактерин новорожденному?
Понятно, что способ лечения микрофлоры ребенка этим пробиотиком и его дозировка напрямую зависит от того, какую форму выпуска вы приобрели.
Вообще, лекарство можно давать перед кормлением. Если вы используете бифидумбактерин сухой для новорожденных во флаконах, то сначала необходимо приготовить суспензию. Для этого в стакан нужно влить кипяченной воды комнатной температуры из расчета 5 мл на каждую дозу препарата. Как правило, количество доз указывается на упаковке. Открыв флакон, в него из стакана вливается небольшое количество воды для растворения. Затем содержимое флакона следует смешать с водой в стакане. В 1 чайной ложке будет 1 доза лекарства. При желании вместо воды для растворения можно использовать грудное молоко или смесь. Дозировка бифидумбактерина для новорожденных составляет 5 доз за раз дважды в день. Обратите внимание, что хранить приготовленную суспензию нельзя!
Дозировка бифидумбактерина для новорожденных составляет 5 доз за раз дважды в день. Обратите внимание, что хранить приготовленную суспензию нельзя!
Касательно того, как разбавлять бифидумбактерин новорожденным в виде порошка в пакетиках, то готовится раствор тем же способом, что и из флакона. В пакетике рассчитано 5 доз, на каждую из которых необходимо взять по 1 чайной ложке воды или молока. Дозировка лекарства составляет по одному пакетику порошка 2-3 раза в сутки.
Бифидумбактерин жидкий выпускается в виде концентрата бифидобактерий. Готовить раствор нет необходимости – лекарство уже готово к применению. Флакон с препаратом следует хорошо встряхнуть перед употреблением. Новорожденным дают по 0,5 -1 мл средства 2-3 раза в день.
В любом случае, решаясь воспользоваться бифидумбактерином для новорожденных от коликов, дисбактериоза или профилактики этих состоянии, обязательно посоветуйтесь с педиатром!
34 отзыва, инструкция по применению
Бифидумбактерин относится к лекарственным средствам, нормализующим кишечную микрофлору. Этот препарат выступает в роли своеобразной «миграционной службы», регулирующей «национальный» состав микробной популяции, населяющей кишечник. Ведь не секрет, что видовой состав бактериальной микрофлоры непостоянен и при определенных обстоятельствах равновесие может быть сдвинуто в сторону патогенных или условно-патогенных микроорганизмов. Все происходит практически как в реальной жизни: когда количество трудовых мигрантов из стран третьего мира достигает критической массы, жди социальных волнений. Применительно к пищеварительному тракту эти «волнения» выражаются в развитии различных кишечных инфекций. Инфекционные кишечные инвазии, в свою очередь, запускают воспалительные и дегенеративные процессы в ЖКТ, вызывают дисбактериоз кишечника, способствуют нарушениям моторики органов пищеварительного тракта и, в большинстве случаев, норовят перейти в хроническую стадию. Широко используемые для устранения кишечных инфекций антибактериальные препараты (включая, естественно, антибиотики) зачастую несут «на хвосте» те или иные побочные реакции: тяжелые аллергии, стойкие дисбактериозы, формирование антибиотикорезистентных бактериальных штаммов (которых впоследствии и «оглоблей не перешибешь» — любое лечение будет бесполезно), угнетение клеточного иммунитета и т.
Этот препарат выступает в роли своеобразной «миграционной службы», регулирующей «национальный» состав микробной популяции, населяющей кишечник. Ведь не секрет, что видовой состав бактериальной микрофлоры непостоянен и при определенных обстоятельствах равновесие может быть сдвинуто в сторону патогенных или условно-патогенных микроорганизмов. Все происходит практически как в реальной жизни: когда количество трудовых мигрантов из стран третьего мира достигает критической массы, жди социальных волнений. Применительно к пищеварительному тракту эти «волнения» выражаются в развитии различных кишечных инфекций. Инфекционные кишечные инвазии, в свою очередь, запускают воспалительные и дегенеративные процессы в ЖКТ, вызывают дисбактериоз кишечника, способствуют нарушениям моторики органов пищеварительного тракта и, в большинстве случаев, норовят перейти в хроническую стадию. Широко используемые для устранения кишечных инфекций антибактериальные препараты (включая, естественно, антибиотики) зачастую несут «на хвосте» те или иные побочные реакции: тяжелые аллергии, стойкие дисбактериозы, формирование антибиотикорезистентных бактериальных штаммов (которых впоследствии и «оглоблей не перешибешь» — любое лечение будет бесполезно), угнетение клеточного иммунитета и т. д. В этой связи усилия инфекционистов на современном этапе развития медицины направлены на допустимое ограничение антибиотикотерапии и постепенный отход от этих порой незаменимых, но очень уж «проблемных» препаратов.
д. В этой связи усилия инфекционистов на современном этапе развития медицины направлены на допустимое ограничение антибиотикотерапии и постепенный отход от этих порой незаменимых, но очень уж «проблемных» препаратов.
Бифидумбактерин в ряде случаев может применяться как адекватная альтернатива антибактериальным препаратам. Прежде всего, бифидумбактерин — это пробиотик, т.е. препарат, в состав которого входят живые микроорганизмы, в норме населяющие кишечник человека. Продвигаясь по «закоулкам» пищеварительного тракта, эти искусственно введенные в организм бактерии сохраняют свою активность и всячески способствуют поддержанию нормального внутреннего «микроклимата», модифицируя состав микрофлоры и влияя на ее метаболизм. Бифидобактерии, входящие в состав бифидумбактерина, антагонистичны по отношению ко многим патогенным и факультативно-патогенным микроорганизмам (здесь можно упомянуть стафилококков, энтеропатогенных кишечных палочкек, протея, шигелл, ряд дрожжеподобных грибов и т.д.). Бифидобактерии восстанавливают баланс микрофлоры кишечника и влагалища, оптимизируют пищеварительную и протективную функции кишечника, повышают неспецифическую устойчивость организма.
Бифидобактерии восстанавливают баланс микрофлоры кишечника и влагалища, оптимизируют пищеварительную и протективную функции кишечника, повышают неспецифическую устойчивость организма.
Бифидумбактеин выпускается сразу в четырех лекарственных формах: таблетки, суппозитории вагинальные и ректальные (форма одна, но могут быть использованы оба пути введения), порошок для приема внутрь и местного применения и лиофилизат для приготовления суспензии. Режим дозирования зависит от цели использования препарата и лекарственной формы. При приготовлении раствора бифидумбактерина не рекомендуется использовать воду, нагретую свыше 40°С. Прием пероральных форм препарата не совместим с приемом антибиотиков.
Обзор, применение, побочные эффекты, меры предосторожности, взаимодействия, дозировка и отзывы
Sadeghi-Bojd S, Naghshizadian R, Mazaheri M, Ghane Sharbaf F, Assadi F. Эффективность пробиотической профилактики после первой лихорадочной инфекции мочевыводящих путей у детей с нормальным мочевыводящие пути. J Pediatric Infect Dis Soc. 2020; 9 (3): 305-310. Просмотр аннотации.
J Pediatric Infect Dis Soc. 2020; 9 (3): 305-310. Просмотр аннотации.
Сато С., Учида Т., Кувана С. и др. Бактериемия, вызванная Bifidobacterium breve у новорожденного с экстрофией клоаки. Pediatr Int. 2016; 58 (11): 1226-8.Просмотр аннотации.
Saxelin M, Chuang NH, Chassy B и др. Лактобациллы и бактериемия на юге Финляндии 1989-1992 гг. Clin Infect Dis 1996; 22: 564-6. Просмотр аннотации.
Scarpignato C, Rampal P. Профилактика и лечение диареи путешественников: клинический фармакологический подход. Химиотерапия 1995; 41: 48-81. Просмотр аннотации.
Шмидт Р.М., Пилманн Лаурсен Р., Бруун С. и др. Пробиотики в позднем младенчестве снижают частоту возникновения экземы: рандомизированное контролируемое исследование. Pediatr Allergy Immunol.2019; 30 (3): 335-340. Просмотр аннотации.
Шариф А, Кашани Х. Х., Насри Э, Сулеймани З., Шариф MR. Роль пробиотиков в лечении дизентерии: рандомизированное двойное слепое клиническое испытание. Пробиотики, антимикробные белки. 2017; 9 (4): 380-385. Просмотр аннотации.
Shavakhi A, Tabesh E, Yaghoutkar A, Hashemi H, Tabesh F, Khodadoostan M, Minakari M, Shavakhi S, Gholamrezaei A. Влияние пробиотического соединения с множеством штаммов на висмутсодержащую четырехкомпонентную терапию для инфекции Helicobacter pylori: рандомизированная плацебо-инфекция. контролируемое тройное слепое исследование.Helicobacter. 2013; 18 (4): 280-4. Просмотр аннотации.
Шэнь Дж., Цзо З.С., Мао А.П. Влияние пробиотиков на вызывание ремиссии и поддерживающую терапию при язвенном колите, болезни Крона и поучите: метаанализ рандомизированных контролируемых исследований. Воспаление кишечника. 2014; 20 (1): 21-35. Просмотр аннотации.
Симрен М., Оман Л., Олссон Дж. И др. Клиническое испытание: влияние ферментированного молока, содержащего три пробиотических бактерии, на пациентов с синдромом раздраженного кишечника — рандомизированное двойное слепое контролируемое исследование.Алимент Фармакол Тер 2010; 31 (2): 218-27. Просмотр аннотации.
Сликерман Р.Ф., Кан Дж., Ван Зил Н. и др. Влияние раннего приема пробиотиков на когнитивные способности, поведение и настроение в детстве — рандомизированное плацебо-контролируемое исследование. Acta Paediatr. 2018; 107 (12): 2172-2178. Просмотр аннотации.
Søndergaard B, Olsson J, Ohlson K, Svensson U, Bytzer P, Ekesbo R. Влияние пробиотической ферментированного молока на симптомы и кишечную флору у пациентов с синдромом раздраженного кишечника: рандомизированное плацебо-контролируемое исследование.Сканд Дж. Гастроэнтерол 2011; 46 (6): 663-72. Просмотр аннотации.
Staudacher HM, Lomer MCE, Farquharson FM, et al. Диета с низким содержанием FODMAP уменьшает симптомы у пациентов с синдромом раздраженного кишечника, а пробиотик восстанавливает виды Bifidobacterium: рандомизированное контролируемое исследование. Гастроэнтерология. 2017; 153 (4): 936-947. Просмотр аннотации.
Стенман Л.К., Лехтинен М.Дж., Меланд Н. и др. Пробиотик с клетчаткой или без нее, связанный с сывороточным зонулином, контролирует жировую массу в рандомизированном контролируемом исследовании для взрослых с избыточным весом и ожирением.EBioMedicine 2016; 13: 190-200. Просмотр аннотации.
Салливан А, Баркхольт Л, Север СЕ. Lactobacillus acidophilus, Bifidobacterium lactis и Lactobacillus F19 предотвращают связанные с антибиотиками экологические нарушения Bacteroides fragilis в кишечнике. Журнал Antimicrob Chemother 2003; 52: 308-11. Просмотр аннотации.
Табберс М.М., Миллиано I, Роузбум М.Г., Беннинга М.А. Эффективны ли Bifidobacterium breve при лечении запоров у детей? Результаты пилотного исследования. Нутр Ж 2011; 10:19.Просмотр аннотации.
Tomasz B, Zoran S, Jaroslaw W, Ryszard M, Marcin G, Robert B, Piotr K, Lukasz K, Jacek P, Piotr G, Przemyslaw P, Michal D. Долгосрочное использование пробиотиков Lactobacillus и Bifidobacterium имеет профилактическое действие влияние на возникновение и тяжесть поучита: рандомизированное проспективное исследование. Biomed Res Int. 2014; 2014: 208064. Просмотр аннотации.
Tursi A, Brandimarte G, Giorgetti GM, et al. Низкие дозы бальсалазида в сочетании с сильнодействующим пробиотическим препаратом более эффективны, чем один бальсалазид или месалазин при лечении острого язвенного колита легкой и средней степени тяжести.Med Sci Monit 2004; 10: PI126-31. Просмотр аннотации.
Вентури А., Джиончетти П., Риццелло Ф. и др. Влияние нового пробиотического препарата на состав фекальной флоры: предварительные данные по поддерживающей терапии больных язвенным колитом. Aliment Pharmacol Ther 1999; 13: 1103-8. Просмотр аннотации.
Videlock EJ, Cremonini F. Мета-анализ: пробиотики при диарее, связанной с антибиотиками. Алимент Pharmacol Ther. 2012; 35 (12): 1355-69. Просмотр аннотации.
Ван Г, Фэн Д.Терапевтический эффект Saccharomyces boulardii в сочетании с Bifidobacterium и на клеточную иммунную функцию у детей с острой диареей. Exp Ther Med. 2019; 18 (4): 2653-2659. Просмотр аннотации.
Ван Ю. Х., Хуанг Ю. Влияние добавок Lactobacillus acidophilus и Bifidobacterium bifidum к стандартной тройной терапии на эрадикацию Helicobacter pylori и динамические изменения кишечной флоры. Мир J Microbiol Biotechnol. 2014; 30 (3): 847-53. Просмотр аннотации.
Ван Чж, Гао Цюй, Фан Цзюй.Метаанализ эффективности и безопасности препаратов пробиотических соединений, содержащих лактобактерии и бифидобактерии, в эрадикационной терапии Helicobacter pylori. J Clin Gastroenterol. 2013; 47 (1): 25-32. Просмотр аннотации.
Whorwell PJ, Altringer L, Morel J, et al. Эффективность инкапсулированного пробиотика Bifidobacterium infantis 35624 у женщин с синдромом раздраженного кишечника. Am J Gastroenterol. Июль 2006; 101 (7): 1581-90. Просмотр аннотации.
Wildt S, Nordgaard I, Hansen U, Brockmann E, Rumessen JJ.Рандомизированное двойное слепое плацебо-контролируемое исследование с Lactobacillus acidophilus La-5 и Bifidobacterium animalis subsp. lactis BB-12 для поддержания ремиссии при язвенном колите. J. Crohns Colitis 2011; 5 (2): 115-21. Просмотр аннотации.
Wu G, Chen X, Cui N, et al. Профилактическое действие добавок Bifidobacterium на неонатальный холестаз у недоношенных новорожденных с очень низкой массой тела при рождении. Гастроэнтерол Рес Прак. 2020; 2020: 4625315. Просмотр аннотации.
Сяо Дж., Кацумата Н., Бернье Ф. и др.Пробиотик bifidobacterium breve в улучшении когнитивных функций у пожилых людей с подозрением на легкие когнитивные нарушения: рандомизированное двойное слепое плацебо-контролируемое исследование. J. Alzheimers Dis. 2020; 77 (1): 139-147. Просмотр аннотации.
Сяо Дж. З., Такахаши С., Одамаки Т. и др. Чувствительность к антибиотикам штаммов бифидобактерий, распространенных на японском рынке. Biosci Biotechnol Biochem. 2010; 74 (2): 336-42. Просмотр аннотации.
Замани Б., Голкар Х.Р., Фаршбаф С. и др. Клинический и метаболический ответ на добавление пробиотиков у пациентов с ревматоидным артритом: рандомизированное двойное слепое плацебо-контролируемое исследование.Int J Rheum Dis 2016; 19 (9): 869-79. Просмотр аннотации.
Акацу, Х., Ивабути, Н., Сяо, Дж. З., Мацуяма, З., Курихара, Р., Окуда, К., Ямамото, Т., и Маруяма, М. Клинические эффекты пробиотических бактерий Bifidobacterium longum BB536 на иммунную систему. Функция и кишечная микробиота у пожилых пациентов, получающих энтеральное зондовое питание. JPEN J Parenter Enteral Nutr 11-27-2012; Просмотр аннотации.
Андраде, С. и Борхес, Н. Влияние ферментированного молока, содержащего Lactobacillus acidophilus и Bifidobacterium longum, на липиды плазмы женщин с нормальным или умеренно повышенным холестерином.J.Dairy Res. 2009; 76 (4): 469-474. Просмотр аннотации.
Арая-Кодзима Томоко, Яэшима Томоко Исибаши Норио Симамура Сейичи Хаясава Хиротоши. Ингибирующее действие Bifidobacterium longum BB536 на вредные кишечные бактерии. Бифидобактерии Microflora 1995; 14 (2): 59-66.
Ballongue J, Grill J Baratte-Euloge P. Экшн по цвету кишечных ферментов с бифидобактериями. Lait 1993; 73: 249-256.
Беннет Р., Норд К. Э. и Зеттерстром Р. Временная колонизация кишечника новорожденных младенцев перорально вводимыми бифидобактериями и лактобактериями.Acta Paediatr. 1992; 81 (10): 784-787. Просмотр аннотации.
Chouraqui, JP, Grathwohl, D., Labaune, JM, Hascoet, JM, de, Montgolfier, I, Leclaire, M., Giarre, M., and Steenhout, P. Оценка безопасности, переносимости и защитного эффекта против диареи смесей для младенцев, содержащих смеси пробиотиков или пробиотиков и пребиотиков, в рандомизированном контролируемом исследовании. Am.J Clin.Nutr. 2008; 87 (5): 1365-1373. Просмотр аннотации.
Дас Р.Р. Сингх М., Шафик Н. Пробиотики в лечении аллергического ринита.Журнал Всемирной организации аллергии 2010; 3 (9): 239-244.
del Giudice, M. M. и Brunese, F. P. Пробиотики, пребиотики и аллергия у детей: что нового за последний год? J Clin.Gastroenterol. 2008; 42 Приложение 3, часть 2: S205-S208. Просмотр аннотации.
Dimidi E, Zdanaviciene A, Christodoulides S, et al. Рандомизированное клиническое испытание: пробиотик Bifidobacterium lactis NCC2818 по сравнению с плацебо и влияние на время прохождения через кишечник, симптомы и микробиологию кишечника при хроническом запоре. Алимент Pharmacol Ther.2019; 49 (3): 251-264. Просмотр аннотации.
Фирмансьях, А., Двапурванторо, П.Г., Кадим, М., Алатас, С., Конус, Н., Лестарина, Л., Буиссе, Ф. и Стинхаут, П. Улучшение роста малышей, которых кормили молоком, содержащим синбиотики . Азия Pac.J Clin.Nutr. 2011; 20 (1): 69-76. Просмотр аннотации.
Джанотти, Л., Морелли, Л., Гальбиати, Ф., Роккетти, С., Коппола, С., Бенедуче, А., Джилардини, К., Зоненсчейн, Д., Несполи, А., и Брага, M. Рандомизированное двойное слепое исследование периоперационного введения пробиотиков пациентам с колоректальным раком.Мир Дж. Гастроэнтерол. 1-14-2010; 16 (2): 167-175. Просмотр аннотации.
Hascoet, J.M., Hubert, C., Rochat, F., Legagneur, H., Gaga, S., Emady-Azar, S., и Steenhout, P.G. Влияние состава смеси на развитие микробиоты кишечника младенцев. J Педиатр, гастроэнтерол, питание. 2011; 52 (6): 756-762. Просмотр аннотации.
Игараси М., Иияма И Като Р. Томита М. Асами Н. Эзава И. Влияние Bifidobacterium longum и лактулозы на прочность кости в моделях остеопороза после овариэктомии.Бифид 1994; 7: 139-147.
Ивабучи Н., Хирута Н. Канетада С. Яешима Т. Ивацуки К. Ясуи Х. Влияние интраназального введения Bifidobacterium longum BB536 на иммунную систему слизистой оболочки дыхательных путей и вирусную инфекцию гриппа у мышей. Наука о молоке 2009; 38 (3): 129-133.
Ивабучи, Н., Такахаши, Н., Сяо, Дж. З., Мияджи, К., и Ивацуки, К. In vitro Th2-независимые цитокин-независимые Th3 подавляющие эффекты бифидобактерий. Microbiol.Immunol. 2007; 51 (7): 649-660. Просмотр аннотации.
Ивабути, Н., Такахаши, Н., Сяо, Дж. З., Йонедзава, С., Яэшима, Т., Ивацуки, К., и Хачимура, С. Подавляющее действие Bifidobacterium longum на производство Th3-привлекающих хемокинов индуцировало с взаимодействиями Т-лимфоцитов с антиген-презентирующими клетками. FEMS Immunol.Med.Microbiol. 2009; 55 (3): 324-334. Просмотр аннотации.
Iwabuchi, N., Xiao, J. Z., Yaeshima, T., and Iwatsuki, K. Пероральное введение Bifidobacterium longum уменьшает инфекцию вируса гриппа у мышей. Биол.Pharm.Bull. 2011; 34 (8): 1352-1355. Просмотр аннотации.
Кагеяма Т., Накано и Томода Т. Сравнительное исследование перорального приема некоторых препаратов бифидобактерий. Медицина и биология (Япония) 1987; 115 (2): 65-68.
Кагеяма Т., Томода Т. Накано Ю. Эффект введения бифидобактерий у пациентов с лейкемией. Бифидобактерии Microflora. 1984; 3 (1): 29-33.
Кондо, Дж., Сяо, Дж. З., Сирахата, А., Баба, М., Абэ, А., Огава, К., и Симода, Т. Модулирующие эффекты Bifidobacterium longum BB536 на дефекацию у пожилых пациентов, получающих энтеральное питание .Всемирный журнал J Gastroenterol 4-14-2013; 19 (14): 2162-2170. Просмотр аннотации.
Мацумото, Т., Исикава, Х., Татеда, К., Яэшима, Т., Исибаши, Н. и Ямагути, К. Пероральное введение Bifidobacterium longum предотвращает кишечный сепсис Pseudomonas aeruginosa у мышей. J Appl.Microbiol. 2008; 104 (3): 672-680. Просмотр аннотации.
Намба К., Яешима Т. Ишибаши Н. Хаясава Х и Ямадзаки Сёдзи. Ингибирующее действие Bifidobacterium longum на энтерогеморрагическую Escherichia coli O157: H7. Биологическая микрофлора 2003; 22 (3): 85-91.
Намба К., Хатано М., Яешима Т., Такасе М. и Сузуки К. Влияние введения Bifidobacterium longum BB536 на инфекцию гриппа, титр антител к вакцине против гриппа и клеточный иммунитет у пожилых людей . Biosci.Biotechnol.Biochem. 2010; 74 (5): 939-945. Просмотр аннотации.
Одамаки, Т., Сугахара, Х., Ёнэдзава, С., Яешима, Т., Ивацуки, К., Танабэ, С., Томинага, Т., Тогаши, Х., Бенно, Ю., и Сяо, JZ Влияние перорального приема йогурта, содержащего Bifidobacterium longum BB536, на количество клеток энтеротоксигенных Bacteroides fragilis в микробиоте.Анаэроб. 2012; 18 (1): 14-18. Просмотр аннотации.
Odamaki, T., Xiao, JZ, Iwabuchi, N., Sakamoto, M., Takahashi, N., Kondo, S., Iwatsuki, K., Kokubo, S., Togashi, H., Enomoto, T. , и Бенно, Ю. Колебания фекальной микробиоты у людей с поллинозом японского кедра во время сезона пыльцы и влияние приема пробиотиков. J Investig.Allergol.Clin.Immunol. 2007; 17 (2): 92-100. Просмотр аннотации.
Одамаки, Т., Сяо, Дж. З., Ивабучи, Н., Сакамото, М., Такахаши, Н., Кондо, С., Мияджи, К., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Влияние приема Bifidobacterium longum BB536 на фекальную микробиоту у людей с поллинозом японского кедра в сезон пыльцы. J Med.Microbiol. 2007; 56 (Pt 10): 1301-1308. Просмотр аннотации.
Одамаки, Т., Сяо, Дж. З., Сакамото, М., Кондо, С., Яешима, Т., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Распространение различных видов группы Bacteroides fragilis у лиц с поллинозом японского кедра.Appl.Environ.Microbiol. 2008; 74 (21): 6814-6817. Просмотр аннотации.
Огата Т., Кингаку М. Яэшима Т. Терагути С. Фукуватари и Ишибаши Н. Хаясава Х. Фудзисава Т. Лино Х. Влияние приема йогурта Bifidobacterium longum BB536 на кишечную среду здоровых взрослых. Microb Ecol Health Dis 1999; 11: 41-46.
Огата Т., Накамура Т. Анджитсу К. Яешима Т. Такахаши С. Фукуватари Й Ишибаши Н. Хаясава Х. Фудзисава Т. Иино Х. Влияние введения Bifidobacterium longum BB536 на кишечную среду, частоту дефекации и фекальные характеристики добровольцев.Biosci Microflora 1997; 16: 53-58.
Орхаге К., Шостедт С. и Норд С. Е. Влияние добавок с молочнокислыми бактериями и олигофруктозой на микрофлору кишечника при введении цефподоксима проксетила. J Antimicrob.Chemother. 2000; 46 (4): 603-612. Просмотр аннотации.
Пуччио, Г., Кахоццо, К., Мели, Ф., Рошат, Ф., Гратволь, Д., и Стинхаут, П. Клиническая оценка новой закваски для младенцев, содержащей живые Bifidobacterium longum BL999 и пребиотики.Питание 2007; 23 (1): 1-8. Просмотр аннотации.
Редди Б. С. и Ривенсон А. Ингибирующее действие Bifidobacterium longum на канцерогенез толстой кишки, молочной железы и печени, индуцированное 2-амино-3-метилимидазо [4,5-f] хинолином, пищевым мутагеном. Cancer Res. 9-1-1993; 53 (17): 3914-3918. Просмотр аннотации.
Rouge, C., Piloquet, H., Butel, MJ, Berger, B., Rochat, F., Ferraris, L., Des, Robert C., Legrand, A., de la Cochetiere, MF, N ‘ Guyen, JM, Vodovar, M., Voyer, M., Darmaun, D., and Roze, J.C. Пероральный прием пробиотиков у недоношенных детей с очень низкой массой тела при рождении: рандомизированное двойное слепое плацебо-контролируемое исследование. Am.J Clin.Nutr. 2009; 89 (6): 1828-1835. Просмотр аннотации.
Секи М., Игараси Т. Фукуда И Симамура С. Касвашима Т. Огаса К. Влияние кисломолочного продукта Bifidobacterium на «регулярность» среди пожилых людей. Nutr Foodstuff 1978; 31: 379-387.
Sekine I, Yoshiwara S Homma N Takanori H Tonosuka S. Влияние молока, содержащего бифидобактерии, на хемилюминесцентную реакцию периферических лейкоцитов и средний корпускулярный объем эритроцитов — возможная роль Bifidobacterium в активации макрофагов.Therapeutics (Япония) 1985; 14: 691-695.
Simakachorn, N., Bibiloni, R., Yimyaem, P., Tongpenyai, Y., Varavithaya, W., Grathwohl, D., Reuteler, G., Maire, JC, Blum, S., Steenhout, P. , Benyacoub, J., и Schiffrin, EJ. Толерантность, безопасность и влияние на фекальную микробиоту энтеральной смеси, дополненной пре- и пробиотиками, у детей в критическом состоянии. J Педиатр, гастроэнтерол, питание. 2011; 53 (2): 174-181. Просмотр аннотации.
Сингх, Дж., Ривенсон, А., Томита, М., Шимамура, С., Ishibashi, N., and Reddy, B. S. Bifidobacterium longum, кишечная бактерия, продуцирующая молочную кислоту, ингибирует рак толстой кишки и модулирует промежуточные биомаркеры канцерогенеза толстой кишки. Канцерогенез 1997; 18 (4): 833-841. Просмотр аннотации.
Soh, SE, Aw, M., Gerez, I., Chong, YS, Rauff, M., Ng, YP, Wong, HB, Pai, N., Lee, BW, and Shek, LP Пробиотические добавки в первые 6 месяцев жизни у азиатских младенцев из группы риска — влияние на экзему и атопическую сенсибилизацию в возрасте 1 года.Клинический опыт аллергии 2009; 39 (4): 571-578. Просмотр аннотации.
Takeda, Y., Nakase, H., Namba, K., Inoue, S., Ueno, S., Uza, N., and Chiba, T. Улучшается регуляция T-bet и молекул плотных контактов с помощью Bifidobactrium longum воспаление толстой кишки при язвенном колите. Воспаление. 2009; 15 (11): 1617-1618. Просмотр аннотации.
Тан, М. Л., Лахтинен, С. Дж., И Бойл, Р. Дж. Пробиотики и пребиотики: клинические эффекты при аллергических заболеваниях. Curr.Opin.Pediatr. 2010; 22 (5): 626-634. Просмотр аннотации.
Томода Т., Накано Ю. Кагеяма Т. Разрастание кишечных Candida и кандидозная инфекция у пациентов с лейкемией: эффект от введения бифидобактерий. Бифидобактерии Microflora 1988; 7 (2): 71-74.
Томода Т., Накано Ю. Кагеяма Т. Вариации в небольших группах постоянной кишечной флоры во время приема противоопухолевых или иммунодепрессивных препаратов. Медицина и биология (Япония) 1981; 103 (1): 45-49.
Сяо Дж., Кондол С Одамаки Т Миядзи К Яешима Т Ивацуки К Тогаши Х Бенно Й.Влияние йогурта, содержащего Bifidobacterium longum BB 536, на частоту дефекации и фекальные характеристики здоровых взрослых: двойное слепое перекрестное исследование. Японский журнал молочнокислых бактерий 2007; 18 (1): 31-36.
Xiao, JZ, Kondo, S., Takahashi, N., Odamaki, T., Iwabuchi, N., Miyaji, K., Iwatsuki, K., and Enomoto, T. Изменения уровней TARC в плазме во время пыльцы японского кедра сезон и связь с развитием симптомов. Int.Arch.Allergy Immunol. 2007; 144 (2): 123-127.Просмотр аннотации.
Xiao, JZ, Kondo, S., Yanagisawa, N., Miyaji, K., Enomoto, K., Sakoda, T., Iwatsuki, K., and Enomoto, T. Клиническая эффективность пробиотика Bifidobacterium longum для лечения симптомов аллергии на пыльцу японского кедра у субъектов, оцениваемых в отделении воздействия окружающей среды. Аллергол. 2007; 56 (1): 67-75. Просмотр аннотации.
Сяо, Дж. З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Ивацуки, К., Кокубо, С., Тогаши, Х., Эномото, К.и Эномото Т. Эффект пробиотика Bifidobacterium longum BB536 [скорректированный] в облегчении клинических симптомов и модуляции уровней цитокинов в плазме поллиноза японского кедра во время сезона пыльцы. Рандомизированное двойное слепое плацебо-контролируемое исследование. J Investig.Allergol.Clin.Immunol. 2006; 16 (2): 86-93. Просмотр аннотации.
Сяо, Д.З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Миядзи, К., Ивацуки, К., Тогаши, Х., Эномото, К. и Эномото Т. Пробиотики в лечении поллиноза японского кедра: двойное слепое плацебо-контролируемое исследование.Клинический опыт аллергии 2006; 36 (11): 1425-1435. Просмотр аннотации.
Яешима Т., Такахаши С. Мацумото Н. Исибаши Н. Хаясава Х. Лино Х. Влияние йогурта, содержащего Bifidobacterium longum BB536, на кишечную среду, фекальные характеристики и частоту дефекации: сравнение со стандартным йогуртом. Biosci Microflora 1997; 16: 73-77.
Яешима Т., Такахаши С Огура А Конно Т. Ивацуки К. Исибаши Н. Хаясава Х. Влияние неферментированного молока, содержащего Bifidobacterium longum BB536, на частоту дефекации и характеристики кала у здоровых взрослых.Журнал Nutrition Food 2001; 4 (2): 1-6.
Яешима Т., Такахаси С Ота С. Накагава К. Ишибаши Н Хирамацу А Охаши Т. Хаясава Х Иино Х. Влияние сладкого йогурта, содержащего Bifidobacterium longum BB536, на частоту дефекации и фекальные характеристики здоровых взрослых людей: сравнение со сладким стандартным йогуртом. Kenko Eiyo Shokuhin Kenkyu 1998; 1 (3/4): 29-34.
Ямазаки, С., Мачии, К., Цуюки, С., Момосе, Х., Кавашима, Т. и Уэда, К. Иммунологические реакции на моноассоциированные Bifidobacterium longum и их связь с предотвращением бактериальной инвазии.Иммунология 1985; 56 (1): 43-50. Просмотр аннотации.
Зивковиц, М., Фекаду, К., Зонтаг, Г., Набингер, У., Хубер, В.В., Кунди, М., Чакраборти, А., Фуасси, Х., и Кнасмюллер, С. Предотвращение образования гетероциклических аминов -индуцированное повреждение ДНК в толстой кишке и печени крыс различными штаммами лактобацилл. Канцерогенез 2003; 24 (12): 1913-1918. Просмотр аннотации.
Аль Фалех К., Анабрис Дж. Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных Syst Rev.2014; (4): CD005496.Просмотр аннотации.
АльФалех К., Анабрис Дж., Басслер Д., Аль-Харфи Т. Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных систематических обзоров 2011 г., выпуск 3. Ст. №: CD005496. DOI: 10.1002 / 14651858.CD005496.pub3. Просмотр аннотации.
Аллен С.Дж., Джордан С., Стори М., Торнтон К.А., Гравенор М.Б., Гараиова И., Пламмер С.Ф., Ван Д., Морган Г. Пробиотики в профилактике экземы: рандомизированное контролируемое исследование. Arch Dis Child 2014; 99 (11): 1014-9. Просмотр аннотации.
Allen SJ, Wareham K, Wang D, Bradley C, Hutchings H, Harris W, Dhar A, Brown H, Foden A, Gravenor MB, Mack D. Лактобациллы и бифидобактерии в профилактике диареи, связанной с антибиотиками, и диареи Clostridium difficile у пожилых стационарных пациентов (PLACIDE): рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование. Ланцет. 2013, 12 октября; 382 (9900): 1249-57. Просмотр аннотации.
Аруначалам К., Гилл Х.С., Чандра РК. Повышение естественной иммунной функции за счет диетического потребления Bifidobacterium lactis (HN019).Eur J Clin Nutr 2000; 54: 263-7. Просмотр аннотации.
Атали-Джапе Г., Минаи Н., Натан Э. и др. Результаты для недоношенных маленьких детей по сравнению с подходящими для беременных после приема Bifidobacterium breve M-16 V. J Matern Fetal Neonatal Med. 2020; 33 (13): 2209-2215. Просмотр аннотации.
Бадехноуш Б., Карамали М., Заррати М. и др. Влияние пробиотических добавок на биомаркеры воспаления, окислительного стресса и исходы беременности при гестационном диабете. J Matern Fetal Neonatal Med.2018 Май; 31 (9): 1128-1136. Просмотр аннотации.
Бастюрк А., Артан Р., Йилмаз А. Эффективность лечения синбиотиками, пробиотиками и пребиотиками при синдроме раздраженного кишечника у детей: рандомизированное контролируемое исследование. Turk J Gastroenterol 2016; 27 (5): 439-43. Просмотр аннотации.
Begtrup LM, de Muckadell OB, Kjeldsen J, Christensen RD, Jarbøl DE. Длительное лечение пробиотиками у пациентов первичного звена с синдромом раздраженного кишечника — рандомизированное двойное слепое плацебо-контролируемое исследование.Сканд Дж. Гастроэнтерол 2013; 48 (10): 1127-35. Просмотр аннотации.
Бибилони Р., Федорак Р.Н., Таннок Г.В. и др. Пробиотическая смесь VSL # 3 вызывает ремиссию у пациентов с активным язвенным колитом. Am J Gastroenterol 2005; 100: 1539-46. Просмотр аннотации.
Blaabjerg S, Artzi DM, Aabenhus R. Пробиотики для профилактики антибиотико-ассоциированной диареи у амбулаторных больных — систематический обзор и метаанализ. Антибиотики (Базель). 2017; 6 (4). Просмотр аннотации.
Bouhnik Y, Pochart P, Marteau P, et al.Восстановление фекалий у людей жизнеспособных бифидобактерий, попавших в ферментированное молоко. Гастроэнтерология 1992; 102: 875-8. Просмотр аннотации.
Батлер С.К., Лау М., Гиллеспи Д. и др. Влияние использования пробиотиков на введение антибиотиков среди жителей домов престарелых: рандомизированное клиническое испытание. ДЖАМА. 2020; 324 (1): 47-56. Просмотр аннотации.
Caglar E. Влияние йогурта, содержащего Bifidobacterium bifidum, на бактерии зубного налета у детей. J Clin Pediatr Dent. 2014; 38 (4): 329-32. Просмотр аннотации.
Callaway LK, McIntyre HD, Barrett HL и др. Пробиотики для профилактики гестационного сахарного диабета у женщин с избыточным весом и ожирением: результаты двойного слепого рандомизированного контролируемого исследования SPRING. Уход за диабетом. 2019; 42 (3): 364-371. Просмотр аннотации.
Chang HY, Chen JH, Chang JH, Lin HC, Lin CY, Peng CC. Пробиотики с множественными штаммами, по-видимому, являются наиболее эффективными пробиотиками в профилактике некротического энтероколита и смертности: обновленный метаанализ. PLoS One.2017; 12 (2): e0171579. Просмотр аннотации.
Чен Р.М., Ву Дж.Дж., Ли С.К. и др. Увеличение кишечных бифидобактерий и подавление бактерий группы кишечной палочки при кратковременном приеме йогурта. J Dairy Sci 1999: 82: 2308-14. Просмотр аннотации.
Chiang BL, Sheih YH, Wang LH, et al. Повышение иммунитета путем употребления с пищей пробиотических молочнокислых бактерий (Bifidobacterium lactis HN019): оптимизация и определение клеточных иммунных ответов. Eur J Clin Nutr 2000; 54: 849-55. Просмотр аннотации.
Colombel JF, Cortot A, Neut C, Romond C. Йогурт с Bifidobacterium longum снижает желудочно-кишечные эффекты, вызванные эритромицином. Ланцет 1987; 2: 43.
Костелое К., Харди П., Ющак Е., Уилкс М., Миллар М.Р .; Пробиотики в совместной группе по изучению недоношенных детей. Bifidobacterium breve BBG-001 у очень недоношенных детей: рандомизированное контролируемое исследование фазы 3. Ланцет. 2016 13 февраля; 387 (10019): 649-60. Просмотр аннотации.
Кремонини Ф, Ди Каро С., Ковино М. и др. Влияние различных пробиотических препаратов на побочные эффекты, связанные с терапией против Helicobacter pylori: параллельное групповое, тройное слепое, плацебо-контролируемое исследование.Am J Gastroenterol 2002; 97: 2744-9. Просмотр аннотации.
Czajeczny D, Kabzi & nacute; ska K, W & oacute; jciak RW. Способствуют ли добавление пробиотиков снижению веса? Рандомизированное простое слепое плацебо-контролируемое исследование с добавлением Bifidobacterium lactis BS01 и Lactobacillus acidophilus LA02. Ешьте расстройство веса. 2020. Посмотреть аннотацию.
Дикерсон Ф., Адамос М., Кацафанас Э. и др. Дополнительные пробиотические микроорганизмы для предотвращения повторной госпитализации пациентов с острой манией: рандомизированное контролируемое исследование.Биполярное расстройство. 2018 25 апреля. Посмотреть аннотацию.
Dimidi E, Christodoulides S, Fragkos KC, Scott SM, Whelan K. Влияние пробиотиков на функциональный запор у взрослых: систематический обзор и метаанализ рандомизированных контролируемых исследований. Am J Clin Nutr. 2014; 100 (4): 1075-84. Просмотр аннотации.
Элмер GW, Суравич CM, МакФарланд LV. Биотерапевтические агенты, метод лечения и профилактики отдельных кишечных и вагинальных инфекций, которым пренебрегают. JAMA 1996; 275: 870-5.Просмотр аннотации.
Eskesen D, Jespersen L, Michelsen B, Whorwell PJ, Müller-Lissner S, Morberg CM. Действие пробиотического штамма Bifidobacterium animalis subsp. lactis, BB-12®, о частоте дефекации у здоровых субъектов с низкой частотой дефекации и дискомфортом в животе: рандомизированное двойное слепое плацебо-контролируемое исследование в параллельных группах. Br J Nutr. 2015 28 ноября; 114 (10): 1638-46. Просмотр аннотации.
Fernández-Carrocera LA, Solis-Herrera A, Cabanillas-Ayón M, Gallardo-Sarmiento RB, García-Pérez CS, Montaño-Rodríguez R, Echániz-Aviles MO.Двойной слепой рандомизированный клинический анализ для оценки эффективности пробиотиков у недоношенных новорожденных с массой тела менее 1500 г в профилактике некротизирующего энтероколита. Arch Dis Child Fetal Neonatal Ed 2013; 98 (1): F5-9. Просмотр аннотации.
Gionchetti P, Rizzello F, Venturi A, et al. Пероральная бактериотерапия в качестве поддерживающей терапии у пациентов с хроническим поучитом: двойное слепое плацебо-контролируемое исследование. Гастроэнтерология 2000; 119: 305-9. Просмотр аннотации.
Goldenberg JZ, Lytvyn L, Steurich J, Parkin P, Mahant S, Johnston BC.Пробиотики для профилактики детской диареи, связанной с приемом антибиотиков. Кокрановская база данных Syst Rev.2015; (12): CD004827. Просмотр аннотации.
Голдин BR. Польза пробиотиков для здоровья. Br J Nutr 1998; 80: S203-7. Просмотр аннотации.
Гор C, Custovic A, Tannock GW, Munro K, Kerry G, Johnson K, Peterson C, Morris J, Chaloner C, Murray CS, Woodcock A. Лечебные и вторичные профилактические эффекты пробиотиков Lactobacillus paracasei или Bifidobacterium lactis на раннем этапе детская экзема: рандомизированное контролируемое исследование с периодом наблюдения до 3 лет.Clin Exp Allergy 2012; 42 (1): 112-22. Просмотр аннотации.
Guardamagna O, Amaretti A, Puddu PE, et al. Добавки бифидобактерий: влияние на липидный профиль плазмы у детей с дислипидемией. Питание. 2014; 30 (7-8): 831-6. Просмотр аннотации.
Ha GY, Yang CH, Kim H, Chong Y. Случай сепсиса, вызванного Bifidobacterium longum. J. Clin Microbiol 1999; 37: 1227-8. Просмотр аннотации.
Хан К., Ван Дж., Сео Дж. Г., Ким Х. Эффективность пробиотиков с двойным покрытием при синдроме раздраженного кишечника: рандомизированное двойное слепое контролируемое исследование.J Gastroenterol. 2017; 52 (4): 432-443. Просмотр аннотации.
Хираяма К., Рафтер Дж. Роль пробиотических бактерий в профилактике рака. Microbes Infect 2000; 2: 681-6. Просмотр аннотации.
Hojsak I, Tokic Pivac V, Mocic Pavic A, Pasini AM, Kolacek S. Bifidobacterium animalis subsp. lactis не предотвращает распространенные инфекции у госпитализированных детей: рандомизированное двойное слепое плацебо-контролируемое исследование. Am J Clin Nutr. 2015 Март; 101 (3): 680-4. Просмотр аннотации.
Hoyos AB. Снижение частоты возникновения некротического энтероколита, связанного с энтеральным введением Lactobacillus acidophilus и Bifidobacterium infantis новорожденным в отделении интенсивной терапии.Int J Infect Dis 1999; 3: 197-202. Просмотр аннотации.
Ibarra A, Latreille-Barbier M, Donazzolo Y, Pelletier X, Ouwehand AC. Эффекты 28-дневного Bifidobacterium animalis subsp. lactis HN019 в отношении времени прохождения через толстую кишку и желудочно-кишечных симптомов у взрослых с функциональным запором: двойное слепое рандомизированное плацебо-контролируемое исследование с определением дозировки. Кишечные микробы. 2018; 9 (3): 236-251. Просмотр аннотации.
Иноуэ Т., Кобаяши Ю., Мори Н. и др. Влияние комбинированного приема бифидобактерий и тренировок с отягощениями на когнитивные функции, состав тела и привычки кишечника здоровых пожилых людей.Benef Microbes. 2018; 9 (6): 843-853. Просмотр аннотации.
Исикава Х., Акедо И., Умесаки Ю. и др. Рандомизированное контролируемое исследование влияния ферментированного бифидобактериями молока на язвенный колит. J Am Coll Nutr 2003; 22: 56-63. Просмотр аннотации.
Isolauri E, Arvola T, Sutas Y, et al. Пробиотики в лечении атопической экземы. Clin Exp Allergy 2000; 30: 1604-10. Просмотр аннотации.
Jäger R, Purpura M, Stone JD и др. Прием пробиотиков Streptococcus thermophilus FP4 и Bifidobacterium breve BR03 снижает работоспособность и объем движений после упражнений, повреждающих мышцы.Питательные вещества 2016; 8 (10). pii: E642. Просмотр аннотации.
Jayasimhan S, Yap NY, Roest Y, Rajandram R, Chin KF. Эффективность препарата микробных клеток в улучшении хронического запора: рандомизированное двойное слепое плацебо-контролируемое исследование. Clin Nutr 2013; 32 (6): 928-34. Просмотр аннотации.
Jiang C, Wang H, Xia C, et al. Рандомизированное двойное слепое плацебо-контролируемое исследование пробиотиков для уменьшения тяжести мукозита полости рта, вызванного химиолучевой терапией, у пациентов с карциномой носоглотки.Рак. 2019; 125 (7): 1081-1090. Просмотр аннотации.
Jiao X, Fu MD, Wang YY, Xue J, Zhang Y. Bifidobacterium и Lactobacillus для предотвращения некротического энтероколита у недоношенных детей с очень низкой массой тела при рождении: систематический обзор и метаанализ. Мир J Pediatr. 2020; 16 (2): 135-142. Просмотр аннотации.
Калима П., Мастертон Р.Г., Родди П.Х. и др. Инфекция Lactobacillus rhamnosus у ребенка после трансплантации костного мозга. J Infect 1996; 32: 165-7. Просмотр аннотации.
Карамали М., Дадхах Ф., Садрханлоу М. и др.Влияние пробиотических добавок на гликемический контроль и липидный профиль при гестационном диабете: рандомизированное двойное слепое плацебо-контролируемое исследование. Диабет Метаб 2016; 42 (4): 234-41. Просмотр аннотации.
Като К., Мизуно С., Умесаки Ю. и др. Рандомизированное плацебо-контролируемое исследование по оценке влияния ферментированного бифидобактериями молока на активный язвенный колит. Алимент Фармакол Тер 2004; 20: 1133-41. Просмотр аннотации.
Kim HJ, Camilleri M, McKinzie S, et al. Рандомизированное контролируемое испытание пробиотика VSL # 3 в отношении кишечного транзита и симптомов синдрома раздраженного кишечника с преобладанием диареи.Алимент Фармакол Тер 2003; 17: 895-904. . Просмотр аннотации.
Кобаяси Y, Кухара Т, Оки М, Сяо Джозеф. Влияние Bifidobacterium breve A1 на когнитивные функции пожилых людей с жалобами на память: рандомизированное двойное слепое плацебо-контролируемое исследование. Benef Microbes. 2019; 10 (5): 511-520. Просмотр аннотации.
Корщунов В.М., Смеянов В.В., Ефимов Б.А. и др. Терапевтическое применение препарата устойчивых к антибиотикам бифидобактерий у мужчин, подвергшихся воздействию высоких доз гамма-излучения. J Med Microbiol 1996; 44: 70-4.Просмотр аннотации.
Кухбахер Т., Отт С.Дж., Хельвиг У. и др. Бактериальная и грибковая микробиота в связи с пробиотической терапией (VSL # 3) при поучите. Кишечник 2006; 55: 833-41. Просмотр аннотации.
Langkamp-Henken B, Rowe CC, Ford AL, Christman MC, Nieves C. Jr, Khouri L, Specht GJ, Girard SA, Spaiser SJ, Dahl WJ. Bifidobacterium bifidum R0071 приводит к большему количеству дней здорового образа жизни и меньшему проценту студентов, испытывающих академический стресс, сообщающих о дне простуды / гриппа: рандомизированное двойное слепое плацебо-контролируемое исследование.Br J Nutr. 2015 14; 113 (3): 426-34. Просмотр аннотации.
Lau AS, Yanagisawa N, Hor YY, et al. Bifidobacterium longum BB536 облегчает заболевания верхних дыхательных путей и регулирует профили кишечной микробиоты у малазийских дошкольников. Benef Microbes. 2018; 9 (1): 61-70. Просмотр аннотации.
Лау С.С., Чемберлен Р.С. Пробиотики эффективны для предотвращения диареи, связанной с Clostridium difficile: систематический обзор и метаанализ. Int J Gen Med. 2016; 9: 27-37. Просмотр аннотации.
Льюис Э.Д., Энтони Дж. М., Кроули, округ Колумбия, и др.Эффективность Lactobacillus paracasei HA-196 и Bifidobacterium longum R0175 в облегчении симптомов синдрома раздраженного кишечника (СРК): рандомизированное плацебо-контролируемое исследование. Питательные вещества. 2020; 12 (4): 1159. Просмотр аннотации.
Льюис С.Дж., Фридман АР. Обзорная статья: использование биотерапевтических средств в профилактике и лечении желудочно-кишечных заболеваний. Aliment Pharmacol Ther 1998; 12: 807-22. Просмотр аннотации.
Leyer GJ, Li S, Mubasher ME, et al. Воздействие пробиотиков на частоту и продолжительность симптомов простуды и гриппа у детей.Педиатрия 2009; 124: e172-e179. Просмотр аннотации.
Ливин В., Пайффер И., Худо С. и др. Штаммы Bifidobacterium из резидентной микрофлоры желудочно-кишечного тракта человека грудного возраста обладают антимикробной активностью. Gut 2000; 47: 646-52. Просмотр аннотации.
Lin CL, Hsu YJ, Ho HH и др. Bifidobacterium longum subsp. Добавка longum OLP-01 во время тренировок по бегу на выносливость улучшает результаты упражнений у бегунов на средние и длинные дистанции: двойное слепое контролируемое испытание. Питательные вещества. 2020; 12 (7): 1972.Просмотр аннотации.
Linn YH, Thu KK, Win NHH. Влияние пробиотиков на предотвращение острой радиационно-индуцированной диареи среди пациентов с раком шейки матки: рандомизированное двойное слепое плацебо-контролируемое исследование. Пробиотики, антимикробные белки. 2019; 11 (2): 638-647. Просмотр аннотации.
Лю Дж, Хуанг XE. Эффективность таблеток жизнеспособных бактерий Bifidobacterium tetragenous для онкологических больных с функциональным запором. Азиатский Pac J Cancer Prev. 2014; 15 (23): 10241-4. Просмотр аннотации.
Macfarlane GT, Каммингс JH.Пробиотики и пребиотики: может ли регулирование активности кишечных бактерий принести пользу здоровью? BMJ 1999; 318: 999-1003. Просмотр аннотации.
Манжалий Э., Вирченко О., Фалалеева Т., Берегова Т., Стреммель В. Лечебная эффективность пробиотического препарата при неалкогольном стеатогепатите: пилотное исследование. J Dig Dis. 2017; 18 (12): 698-703. Просмотр аннотации.
Мацуока К., Уэмура Ю., Канаи Т. и др. Эффективность ферментированного молока Bifidobacterium breve в поддержании ремиссии язвенного колита.Dig Dis Sci. 2018; 63 (7): 1910-1919. Просмотр аннотации.
McFarland LV. Мета-анализ пробиотиков для профилактики диареи, связанной с антибиотиками, и лечения болезни Clostridium difficile. Am J Gastroenterol 2006; 101: 812-22. Просмотр аннотации.
Мейдани С.Н., Ха В.К. Иммунологические эффекты йогурта. Am J Clin Nutr 2000; 71: 861-72. Просмотр аннотации.
Майкл Д.Р., Джек А.А., Мазетти Дж. И др. Рандомизированное контролируемое исследование показывает, что добавление лактобактерий и бифидобактерий взрослым с избыточным весом и ожирением снижает массу тела и улучшает самочувствие.Научный доклад 2020; 10 (1): 4183. Просмотр аннотации.
Miele E, Pascarella F, Giannetti E. et al. Влияние пробиотического препарата (VSL # 3) на индукцию и поддержание ремиссии у детей с язвенным колитом. Am J Gastroenterol 2009; 104: 437-43. Просмотр аннотации.
Мимура Т., Риццелло Ф., Хельвиг У. и др. Терапия пробиотиками в высоких дозах (VSL # 3) один раз в день для поддержания ремиссии при рецидивирующем или рефрактерном поухите. Кишечник 2004; 53: 108-14. Просмотр аннотации.
О’Каллаган А, ван Синдерен Д.Бифидобактерии и их роль как членов кишечной микробиоты человека. Front Microbiol. 2016 15 июня; 7: 925. Просмотр аннотации.
О’Махони Л., Маккарти Дж., Келли П. и др. Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и взаимосвязь с профилями цитокинов. Гастроэнтерология 2005; 128: 541-51. Просмотр аннотации.
Olivares M, Castillejo G, Varea V, Sanz Y. Двойное слепое рандомизированное плацебо-контролируемое исследование для оценки эффектов Bifidobacterium longum CECT 7347 у детей с впервые диагностированной целиакией.Br J Nutr. 2014 июл 14; 112 (1): 30-40. Просмотр аннотации.
Park MS, Kwon B, Ku S, Ji GE4. Эффективность лечения пробиотиками Bifidobacterium longum BORI и Lactobacillus acidophilus AD031 у младенцев с ротавирусной инфекцией. Питательные вещества. 2017; 9 (8). pii: E887. Просмотр аннотации.
Phuapradit P, Varavithya W., Vathanophas K, et al. Снижение ротавирусной инфекции у детей, получающих смесь с бифидобактериями. J Med Assoc Thai 1999; 82: S43-8. Просмотр аннотации.
Пирс А.Практическое руководство по натуральным лекарствам Американской фармацевтической ассоциации. Нью-Йорк: The Stonesong Press, 1999: 19.
Pinto GS, Cenci MS, Azevedo MS, Epifanio M, Jones MH. Действие йогурта, содержащего Bifidobacterium animalis subsp. lactis DN-173010 пробиотик на зубном налете и слюне у ортодонтических пациентов. Caries Res. 2014; 48 (1): 63-8. Просмотр аннотации.
Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Пробиотик Bifidobacterium longum NCC3001 снижает показатели депрессии и изменяет активность мозга: пилотное исследование у пациентов с синдромом раздраженного кишечника.Гастроэнтерология 2017; 153 (2): 448-459.e8. Просмотр аннотации.
Pruccoli G, Silvestro E, Pace Napoleone C, Aidala E, Garazzino S, Scolfaro C. Безопасны ли пробиотики? Бифидобактериальная бактериемия у ребенка с тяжелой сердечной недостаточностью. Infez Med. 2019; 27 (2): 175-178. Просмотр аннотации.
Расталл РА. Бактерии в кишечнике: друзья и враги и как изменить баланс. J Nutr 2004; 134: 2022S-2026S. Просмотр аннотации.
Rautava S, Kainonen E, Salminen S, Isolauri E. Материнский пробиотик добавление во время беременности и кормления грудью снижает риск экземы у младенца.J Allergy Clin Immunol. 2012; 130 (6): 1355-60. Просмотр аннотации.
Раутио М., Джусими-Сомер Х, Каума Х и др. Абсцесс печени, вызванный штаммом Lactobacillus rhamnosus, неотличимым от штамма L. rhamnosus GG. Clin Infect Dis 1999; 28: 1159-60. Просмотр аннотации.
Rerksuppaphol S, Rerksuppaphol L. Рандомизированное контролируемое исследование пробиотиков для лечения простуды у школьников. Pediatr Int. 2012; 54 (5): 682-7. Просмотр аннотации.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr 2000; 71: 1682S-7S.Просмотр аннотации.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr. 2000; 71 (6 доп.): 1682С-7С; обсуждение 1688С-90С. Просмотр аннотации.
Saavedra JM, et al. Кормление младенцев в больнице бифидобактериями бифидум и термофильным стрептококком для профилактики диареи и выделения ротавируса. Ланцет 1994; 344: 1046-9. Просмотр аннотации.
Zhang J, Ma S, Wu S, Guo C, Long S, Tan H. Эффекты пробиотических добавок у беременных с гестационным сахарным диабетом: систематический обзор и метаанализ рандомизированных контролируемых исследований.J Diabetes Res. 2019; 2019: 5364730. Просмотр аннотации.
Чжу XL, Тан XG, Цюй Ф, Чжэн Y, Чжан WH, Diao YQ. Bifidobacterium может способствовать профилактике некротического энтероколита у недоношенных детей: систематический обзор и метаанализ. Int J Surg. 2019; 61: 17-25. Просмотр аннотации.
Bifidobacterium adolescentis как ключевой член микробиоты кишечника человека в производстве ГАМК
Штаммы Bifidobacterium adolescentis и условия ростаВсе штаммы, использованные в этом исследовании, культивировались в анаэробной атмосфере (10% H 2 10% CO 2 и 80% N 2 ) в анаэробной камере MG500 (Don Whitley Scientific, Западный Йоркшир, Соединенное Королевство) на бульоне Де Ман-Рогоза-Шарпа (MRS) (BD-Difco Biosciences, Сан-Диего, CA) с добавлением 0.25% (мас. / Об.) L-цистеина гидрохлорида (Sigma-Aldrich) и инкубировали при 37 ° C в течение различного времени (таблица 1).
Измерение продукции ГАМК
Для определения продукции ГАМК штаммы субкультивировали в MRS с добавлением 2 мМ глутамата натрия (GMS, Sigma-Aldrich) и выращивали в течение 48 часов в анаэробных условиях при 37ºC. Продукция ГАМК оценивалась с помощью ВЭЖХ на бесклеточных супернатантах после дериватизации диэтилэтоксиметиленмалоната (DEEM, Sigma-Aldrich) в соответствии со следующими показаниями 29 .После центрифугирования (18000 г в течение 10 мин) супернатанты фильтровали через шприцевые фильтры (диаметр 13 мм, размер пор 0,22 мкм, мембрана PTFE, VWR International, Radnor, PA, USA). Аликвоты по 100 мкл тщательно перемешивали встряхиванием со 175 мкл боратного буфера (1 М борная кислота, pH 9,0), 75 мкл метанола, 3 мкл DEEM и 2 мкл 2-л-аминоадипиновой кислоты (исходный раствор 2 мг / мл −1 ) (Sigma-Aldrich) в качестве внутреннего стандарта. Смеси выдерживали в ультразвуковой водяной бане при 30 ° C в течение трех 15-минутных циклов.Затем образцы выдерживали при 70ºC на водяной бане в течение 2 ч для удаления избытка ДЭМ. Наконец, образцы центрифугировали в течение 5 минут при 11000 g и супернатанты дополнительно фильтровали через мембраны 0,22 мкм.
ГАМК определяли с помощью обращенно-фазовой (RP) -HPLC в колонке Ascentis C18 (250 × 4,6 мм, 5 мкм), соединенной с предколонкой Supelguard Ascentis C18 (20 × 4,0 мм) (Supelco, Sigma- Олдрич, Сент-Луис, Миссури), используя хроматографическую систему, состоящую из модуля разделения Alliance 2695, детектора УФ-видимого PDA 2996 и программного обеспечения для сбора / анализа Empower (Waters, Милфорд, Массачусетс, США).Разделение проводили при 35ºC с градиентом подвижной фазы: 25 мМ ацетатный буфер pH 6,7 плюс 0,02% азид натрия (элюент A), ацетонитрил (элюент B) и метанол (элюент C) 30 . Образцы (5 мкл) вводили, разделяли при скорости потока 1 мл мин. -1 (общий объем рома 100 мин), и ГАМК определяли при 280 нм. Количественную оценку выполняли с использованием шаблона внешней калибровки с использованием известных концентраций стандарта ГАМК (Sigma), подвергнутых той же процедуре дериватизации, для получения соответствующего уравнения линейной регрессии (R 2 > 0.99). Все определения выполняли, по крайней мере, в двух независимых биологических повторностях.
Секвенирование генома и сборки
На основании результатов, полученных при производстве GABA между 82 штаммами B. adolescentis , два репрезентативных штамма, классифицированных как продуценты с высоким уровнем GABA, а именно B. были подвергнуты секвенированию генома дробовика. ДНК, выделенная из B. adolescentis, PRL2019 и B.adolescentis HD17T2H были подвергнуты полногеномному секвенированию с использованием MiSeq (Illumina, UK) в GenProbio srl (Parma, Италия) в соответствии с протоколом поставщика (Illumina, UK). Более того, чтобы улучшить качество генома B. adolescentis PRL2019, его ДНК была извлечена и подвергнута полногеномному секвенированию с использованием подхода MinION (Oxford Nanopore, Великобритания) в GenProbio srl (Парма, Италия) в соответствии с заявлением поставщика. протокол (Oxford Nanopore, Великобритания). Файлы Fastq чтения парных концов, полученные в результате целевого секвенирования генома изолированных штаммов, были использованы в качестве входных данных для сборок генома через конвейер MEGAnnotator 31 .Программное обеспечение SPAdes использовалось для сборки de novo каждой последовательности генома Bifidobacterium adolescentis 32,33 , в то время как открытые рамки считывания (ORF) были предсказаны с использованием Prodigal 34 . Глубина охвата этих недавно выделенных хромосом B. adolescentis варьировала от 91 до 279 раз, что при сборке генерировало 12 контигов и полную хромосомную последовательность, соответственно.
Идентификация локуса антипортера GAD / GABA
Мы извлекли протеом 1022 штаммов Bifidobacterium из общедоступной базы данных Национального центра биотехнологической информации (NCBI) (таблица S1).Соответственно, мы оценили, какие виды бифидобактерий кодируют гены, необходимые для продукции ГАМК, с помощью поиска локального выравнивания с аминокислотными последовательностями бифидобактериальной эталонной глутаматдекарбоксилазы NCBI (GadB) и глутамат / ГАМК-антипортер (GadC) (доступ: ADB10338.1 и VEG24324. 1). Предполагаемые белки GadB и GadC из 1022 штаммов Bifidobacterium были идентифицированы с помощью BLASTP (граничное значение E, 1 × 10 -30 и 50% идентичность по меньшей мере 80% обеих белковых последовательностей).
Метагеномный скрининг с дробовиком
последовательностей гена B. adolescentis и gadЧтобы исследовать присутствие B. adolescentis и изучить наличие gad генов в микробиоте людей, проявляющих депрессию и тревогу поведения, мы проанализировали два общедоступных набора метагеномных данных, связанных с этими заболеваниями (PRJNA496479 и PRJNA474710). В этом контексте мы собрали метагеномные данные когорты детей младшего школьного возраста с сочетанием субклинических симптомов психического здоровья депрессии и тревоги (PRJNA496479) и хорошо охарактеризованной модели подверженных стрессу крыс Sprague Dawley, демонстрирующих депрессивные — и тревожное поведение из-за социального поражения (PRJNA474710).Каждый набор данных был отфильтрован для получения только высококачественных чтений (минимальный средний показатель качества 20; размер окна 5; порог качества 25; минимальная длина 80) с использованием сценария fastq-mcf (https://expressionanalysis.github.io/ea-utils /). Полученные считывания были сопоставлены с геномами Homo sapiens и Rattus norvegicus с использованием программы Burrows-Wheeler Aligner 35 (алгоритм BWA-MEM с триггером повторного посева, 1,5; минимальная длина семян, 19; оценка совпадения, 1; несоответствие штраф, 4; штраф за открытие пробела, 6; и штраф за удлинение пробела, 1) и дальнейшую обработку с помощью программного пакета SAMtools 36 для удаления считывания человека и крысы.Наконец, отфильтрованные считывания использовались для идентификации операций чтения, связанных с B. adolescentis , в наборе данных для каждой выборки с помощью Bowtie2 37 посредством сопоставления множественных совпадений и «очень чувствительной» политики. Сопоставление было выполнено с использованием функции минимального порога оценки (–score-min C, -13,0), чтобы ограничить считывания произвольной длины двумя несоответствиями и сохранить эти совпадения с идентичностью не менее 98% полной длины. Для подсчета числа считываний, соответствующих генам бифидобактерий, использовалось программное обеспечение HTSeq 38 , работающее в режиме объединения.
План экспериментов in vivo
В экспериментах участвовали самцы крыс Groningen дикого типа в возрасте 5 месяцев ( R. norvegicus ). Эта линия крыс, первоначально полученная из Университета Гронингена (Нидерланды), была выведена в помещении для животных Университета Пармы в стандартных условиях. С самого начала экспериментов крыс содержали индивидуально в клетках из полиметилметакрилата (оргстекла) (39 см × 23 см × 15 см). Крыс содержали в помещениях с контролируемой температурой (22 ± 2 ° C) и влажностью (60 ± 10%) и поддерживали в цикле 12/12 свет / темнота (свет включался с 19:00 до 7:00 ч) с едой. и вода без ограничений.Первая неделя представляла собой период акклиматизации, в течение которого крысы продолжали потреблять стандартную пищу с добавлением перорального приема 500 мкл раствора сахарозы (2%) для адаптации к питью из шприца. В течение следующих 5 дней крыс (n = 32) рандомизировали в 4 группы и перорально вводили с помощью шприца: (1) B. adolescentis ATCC15703; (2) B. adolescentis PRL2019; (3) B. adolescentis HD17T2H; (4) только раствор сахарозы (т.е.е., отрицательный контроль) (Таблица S2). Обработку штаммами B. adolescentis ежедневно вводили шприцем из расчета 10 9 КОЕ на крысу. Перед обработкой микробные культуры культивировали, как описано ранее, и образцы фекалий крыс анализировали, чтобы убедиться в отсутствии штаммов B. adolescentis с помощью специальных праймеров. Затем бактериальные культуры собирали центрифугированием (3000 об / мин в течение 8 мин), промывали и ресуспендировали в 500 мкл 2% (мас. / Об.) Раствора сахарозы.Подсчет жизнеспособности каждого инокулята определяли ретроспективным посевом на MRS. Для оценки колонизации бифидобактериями образцы фекалий собирали в четырех различных временных точках. Первый сбор образцов проводили перед пероральным введением бифидобактерий (T 0 ), чтобы получить доступ к исходной концентрации ГАМК у каждой крысы. Затем мы собрали пробы фекалий на 2, 4 и 7 дней (T 1 , T 2 и T 3 ), чтобы покрыть множественным взятием образцов дни приема пероральных бифидобактериальных добавок (рис.4а). До использования фекалии хранили при -80 ° C.
Экстракция ДНК и кПЦР
Экстракция бактериальной ДНК из образцов фекалий крыс выполнялась в соответствии с протоколом производителя для мини-набора стула QIAamp Fast DNA (Qiagen Ltd, Штрассе, Германия). Наличие бифидобактериальной ДНК оценивали в образцах фекалий крыс. Количественная ПЦР (qPCR) выполнялась, как описано ранее 39 . Штамм-специфичные праймеры были разработаны для идентификации различных штаммов B. adolescentis в образцах фекалий.Праймеры Bado_PRL2019_fw (5′-GAGCAGGCAAGGACACTTTC-3 ‘) и Bado_PRL2019_rev (5′-CTGAAGAGGCAAGCTTGAGG-3’) использовали для B. adolescentis PRL2019; праймеры Bado_HD17T2M_fw (5′-CGGCTACAGGTTCGCTTATC-3 ‘) и Bado_ HD17T2H_rev (5′-TTCCGCAGTAATTCGAGCTT-3’) использовали для B. adolescentis HD17T2H; и Bado_ATCC15703_fw (5′-GGTGATTACGCAGCATCCTT-3 ‘) и Bado_ATCC15703_rev (5′-CTTCCTCACAAACGTCAGCA-3’) были использованы для B. adolescentis ATCC15703. Продукты ПЦР детектировали зеленым флуоресцентным красителем SYBR и амплифицировали согласно следующему протоколу: один цикл при 95 ° C в течение 2 минут, затем 42 цикла при 95 ° C в течение 15 с и Tm 62 ° C для B.adolescentis PRL2019, 64 ° C B. adolescentis HD17T2H и 60 ° C B. adolescentis ATCC15703, в течение 30 с. Кривая плавления составляла от 65 ° C до 95 ° C с шагом 0,5 ° C / с. В каждый прогон был включен отрицательный контроль (без ДНК) для каждого набора праймеров.
Экстракция РНК и qRT-PCR
Чтобы оценить экспрессию генов, участвующих в продукции ГАМК, мы извлекли общую РНК из образцов фекалий крыс. 0,4 г образца стула смешивали с 1 мл QIAzoL Lysis Reagent (Qiagen, UK) и переносили в стерильную пробирку, содержащую стеклянные шарики (Merck, Германия).Клетки лизировали на гомогенизаторе Precellys 24 (Bertin instruments, Франция). Протокол предусматривает 2 мин перемешивания смеси чередование с 2 мин статическим охлаждением; этот шаг был повторен трижды. Клетки центрифугировали при 12000 об / мин в течение 15 мин и верхнюю фазу отделяли. Образцы РНК очищали с помощью набора RNAesy Mini Kit (Qiagen, UK) в соответствии с протоколом производителя. Концентрацию и чистоту РНК оценивали на микролитровом спектрофотометре Picodrop (Picodrop, Великобритания).кДНК синтезировали и очищали с использованием набора iScript cDNAsynthesis (Bio-Rad, Калифорния, США) в соответствии с инструкциями поставщика. Праймеры, используемые для нормализации данных, были разработаны для генов домашнего хозяйства, то есть rpoB и atpB , как описано ранее 40 , в то время как для гена gad B были использованы праймеры GadB_fw (5′-CACATGCTCGCCGATCTATG-3 ‘) и GadB_rev (5’-TCGACCGGCTCATACATACC-3 ‘), тогда как для гена gad C использовались праймеры GadC_fw (5′-GTCTCGCTTCCATTCTGCTG-3′) и GadC_rev (5′-CGAACACATACGAC’GCTG-3 ‘qRT-PCR выполняли с использованием системы CFX96 (Bio-Rad, Калифорния, США). Продукты ПЦР детектировали зеленым флуоресцентным красителем SYBR и амплифицировали в соответствии со следующим протоколом: один цикл при 95 ° C в течение 2 минут, затем 42 цикла при 95 ° C в течение 15 секунд и 60 ° C в течение 30 секунд. Кривая плавления составляла от 65 ° C до 95 ° C с шагом 0,5 ° C / с. В каждый запуск включали отрицательный контроль (без кДНК) для каждого набора праймеров. Коэффициент экспрессии выбранных генов рассчитывали и анализировали с использованием программного обеспечения CFX Manager Expression (Bio-Rad, Калифорния, США).
Измерение ГАМК в фекалиях крыс
Фекалии каждой крысы в разные моменты времени разбавляли 1:10 (вес / объем) в воде milli-Q для получения фекальных вод. Каждый образец перемешивали до дезагрегации фекалий и центрифугировали при 5000 об / мин в течение 5 минут, сохраняя фракцию супернатанта. Эту водную фракцию использовали для количественного определения ГАМК с использованием набора GABA ELISA (LDN Diagnostics, Германия) в соответствии с инструкциями производителя. Коэффициент разбавления учитывали при расчете ГАМК.
Статистический анализ
Программное обеспечение SPSS v.25 (IBM, Италия) использовалось для проведения статистического анализа метагеномных данных сегуна тревожных и депрессивных детей и здоровых субъектов (BioProjects PRJNA496479) с помощью теста Стьюдента t . Размер выборки между группами оценивался с помощью Statulator (https://statulator.com/SampleSize/ss2M.html).
Заявление об этике
Все экспериментальные процедуры и протоколы с участием животных были одобрены Министерством здравоохранения Италии и Ветеринарным комитетом по уходу и использованию животных Пармского университета (номер разрешения 370/2018) и проводились в соответствии с Директивами Совета Европейского сообщества от 22 сентября 2010 г. (2010/63 / UE).
Инфекция гриппа вызывает расширение кишечной популяции эндогенных Bifidobacterium animalis, которые защищают мышей от инфекции | Genome Biology
Клинические признаки и гистопатологические поражения легких различаются у мышей, которые умерли или пережили инфекцию гриппа. (GX) и аттенуированный (HB) вирус H7N9 с использованием подхода LD
50 (подробности о двух вирусах см. В разделе «Материалы и методы»).Следовательно, мышей C57BL / 6 инфицировали дозой вирулентного штамма H7N9 LD 50 (группа GX), такой же нагрузкой ослабленного вируса (группа HB) или им вводили физиологический раствор с фосфатным буфером (PBS) (отрицательный контроль). Группа NC). Наблюдали за массой тела и выживаемостью животных, а образцы фекалий собирали ежедневно после заражения. Все мыши в группе GX демонстрировали очевидные клинические признаки инфекции, включая потерю веса, анорексию, дрожь и грубую шерсть. Выживаемость в этой группе составила 53.3% (16/30) (рис. 1а). Напротив, все мыши в группах NC и HB выжили и не проявили явных симптомов инфекции. Кроме того, в зависимости от того, умерли ли они от инфекции или выжили после нее, мыши в группе GX были разделены на группу смерти ( n = 14, GX.DG) и группу выживания ( n = 16, GX.SG. ), соответственно. Из группы GX.SG 10 мышей были случайным образом выбраны из 16 мышей в качестве представителя этой группы. Кривые процентилей для веса тела мышей показали, что мыши в группе GX.Группа DG потеряла больше массы тела, чем группа GX.SG (рис. 1b). Для дальнейшей оценки различий между группами GX.DG и GX.SG был проведен повторный эксперимент. На 10-й день после заражения мыши из группы GX, которые умерли, сформировали группу GX.DG, тогда как те мыши, которые выжили и начали показывать признаки улучшения, составили группу GX.SG. Действительно, вскрытие и гистологическое исследование показали, что поражения легких у мышей GX.DG были заметно более серьезными, чем у мышей GX.SG мышей (рис. 1c и дополнительный файл 1: рис S1). Взятые вместе, эти результаты продемонстрировали, что мыши, которые умерли или выжили после инфекции с той же дозой вируса гриппа, имеют явно разные клинические признаки и очевидные гистопатологические различия, что представляет гетерогенный ответ на инфекцию и подтверждает, что подход LD 50 может быть использован для различать индивидуальные реакции на инфекцию. Рис. 1Гетерогенность реакции мышей на инфекцию гриппа тесно связана с микробиотой кишечника. a , b SPF C57BL / 6 мышей интраназально инфицировали LD 50 дозой вирулентного штамма вируса H7N9 GX ( n = 30, 50 мкл / мышь), такой же дозой ослабленного вируса H7N9. штамм HB ( n = 10,50 мкл / мышь), или вводили равный объем PBS (группа NC) ( n = 10,50 мкл / мышь). a Выживаемость мышей. b Похудание мышей. На основании выживаемости мышей, инфицированных GX, разделили на группу, пережившую инфекцию (GX.SG) и группа, скончавшаяся от инфекции (GX.DG). Данные представлены как среднее значение ± стандартное отклонение. c H&E окрашивание легкого мыши. Мышей умерщвляли на 10-й день после заражения в другом повторном эксперименте и собирали легкие. Мыши в группе GX, которые умерли от инфекции, входили в группу GX.DG ( n = 3), а мыши в группе GX, которые начали показывать улучшение, были определены как группа GX.SG ( n = 3), а также группу HB ( n = 3) и группу NC ( n = 3).Показаны репрезентативные изображения. d Экспериментальная установка для экспериментов FMT. Фекальные микробы были собраны на 3 и 9 дни после инфицирования GX ( n = 20) и были разделены на группы GX.SG ( n = 10) и GX.DG ( n = 10) в зависимости от того, были ли мыши, у которых были взяты образцы, умерли от инфекции или выжили. Мыши SPF, которых лечили раствором антибиотика (ATB) в течение 3 дней, подверглись FMT фекальных микробов, как указано.Через день после FMT мышей инфицировали дозой GX LD 50 . e , f Выживаемость GX-инфекции у мышей после FMT фекалий от GX-инфицированных мышей, полученных на 3-й ( e ) или 9-й день ( f ) после инфицирования или фекалий NC мышей; выживаемость мышей, которым вводили PBS, до инфицирования GX показана в качестве контроля ( n = 20 мышей на группу). Статистические данные в анализе выживаемости проводились с использованием логарифма (Mantel-Cox). Все эксперименты проводились как минимум дважды в одинаковых условиях и дали аналогичные результаты.
Перенос фекальной микробиоты от мышей, переживших вирусную инфекцию гриппа, увеличивает устойчивость мышей-реципиентов к гриппу. Инфекция гриппа связана с микробиотой кишечника, затем мы провели трансплантацию фекальной микробиоты (FMT) (рис.1г). Затем оценивали влияние фекальной микробиоты, перенесенной от мышей, которые умерли или пережили вирулентную инфекцию, на инфицирование вирусом GX у мышей-реципиентов. FMT фекальной микробиоты, собранной у мышей GX.SG на 3 или 9 день после инфицирования, значительно увеличивал выживаемость мышей-реципиентов перед инфекцией гриппа по сравнению с устойчивостью мышей, которым была трансплантирована фекальная микробиота от неинфицированных мышей (донор NC) или которые мышей, получавших PBS (рис. 1e, f). Напротив, FMT фекальной микробиоты, собранной на 9 день после инфицирования из GX.Мыши DG снижали выживаемость мышей-реципиентов после заражения гриппом (рис. 1f). Эти результаты показали, что фекальная микробиота мышей, переживших инфекцию, вероятно, содержит специфические кишечные микробы, обеспечивающие защиту от гриппа.
Микробиота кишечника демонстрирует очевидные дифференциальные характеристики в зависимости от тяжести инфекции гриппа. 16 дней, что длился эксперимент.Для более интуитивного анализа данных образцы из 16 временных точек были сгруппированы по четырем стадиям заражения: стадия 1 (день 0), контроль; 2 этап (1–4 дни) — этап стабильного веса; 3 этап (5–8 дни), этап похудания; и стадия 4 (9-15 дни), стадия смерти. Анализ индекса разнообразия Шеннона показал, что численность и разнообразие бактериального сообщества следовали тенденции к снижению на стадии 4 у мышей GX.DG, но не у мышей GX.SG, HB или NC (дополнительный файл 2: рис S2). Кроме того, анализ основных координат (PCoAs) взвешенных расстояний UniFrac показал заметный сдвиг в структуре микробиомного сообщества в GX.Образцы DG с прогрессированием заболевания, особенно на стадии 4, тогда как в группах GX.SG и HB наблюдалось лишь небольшое изменение. Напротив, в группе NC сдвига практически не наблюдалось (рис. 2а). Межгрупповой анализ показал аналогичные результаты: кластеризация образцов на последней стадии заражения выявила различия между группой GX.DG и тремя другими группами (дополнительный файл 3: рис. S3).
Рис. 2Инфекция вируса гриппа изменяет микробиоту кишечника в различной степени у отдельных мышей.Образцы фекалий собирали на 0-15 дни после заражения в эксперименте, показанном на рис. 1a, b. Основываясь на выживаемости, мышей, инфицированных GX, разделили на группу, пережившую инфекцию (GX.SG), и группу, которая умерла от инфекции (GX.DG). Все пробы кала также были разделены на соответствующие группы. Группы GX.DG, GX.SG, NC и HB содержали 156, 160, 160 и 160 образцов фекалий для анализа секвенирования гена 16S рРНК соответственно. — PCoA взвешенных расстояний UniFrac среди GX.Группы DG, GX.SG, HB и NC. b Относительное количество типов бактерий в группах GX.DG, GX.SG, HB и NC. c Типы бактерий, демонстрирующие значительные различия в численности (* P <0,05, ** P <0,01, *** P <0,001, критерий Вилкоксона-Манна-Уитни). Для более интуитивного анализа данных ( a — c ) образцы из 16 временных точек были сгруппированы по четырем стадиям заражения: стадия 1 (день 0), контроль; 2 этап (1–4 дни) — этап стабильного веса; 3 этап (5–8 дни), этап похудания; и стадия 4 (9-15 дни), стадия смерти. d Тенденции изменения численности некоторых бактерий на уровне рода
Кроме того, подробный таксономический анализ кишечной микробиоты на уровне филумов выявил очевидные изменения в таксономическом составе бактерий в микробиоте кишечника мышей, инфицированных штаммом GX. особенно у мышей GX.DG (рис. 2b). Некоторые типы демонстрировали сходные тенденции изменчивости в группах GX.DG и GX.SG; например, в обеих группах мышей Elusimicrobia и Proteobacteria стали более многочисленными, чем в группе NC, в то время как Bacteroidetes стали менее многочисленными, чем в группе NC по мере продолжения инфекции, хотя изменения в численности Elusimicrobia были более заметными (рис.2c и Дополнительный файл 4: Рис. S4). Помимо этих сходств, между группами GX.DG и GX.SG были очевидны некоторые различия: например, во время инфекции численность Verrucomicrobia значительно увеличилась только в группе GX.DG, тогда как численность Actinobacteria явно увеличилась только в группе. группу GX.SG по сравнению с группой NC (рис. 2c). Кроме того, тенденции изменения численности Firmicutes заметно колебались с более высокой численностью в GX.DG, чем в GX.SG на третьем этапе после заражения, но наоборот на четвертом этапе (дополнительный файл 4: рис. S4). Эти результаты показали, что заражение вирулентным штаммом вируса H7N9 значительно изменило состав микробиоты кишечника с четкими различиями между группами инфицированных и неинфицированных, а также мертвых и выживших мышей.
Чтобы более подробно изучить влияние инфекции гриппа на микробиоту кишечника, мы провели таксономический анализ микробиоты кишечника на уровне родов.Основываясь на тенденциях изменения кишечных микробов в четырех группах мышей, микробы с различным обилием были разделены на шесть групп (рис. 2d и дополнительный файл 5: рис. S5): (1) бактерии с повышенной численностью только в группе GX.DG. ( Akkermansia , Bacteroides , Parabacteroides , неопознанные Gastranaerophilales , Butyricimonas и неидентифицированные Ruminococcaceae ), (2) бактерии, численность которых сначала увеличилась только в Gastranaerophilales, а затем в GXX, уменьшилась.Группа DG ( Enterorhabdus , Adlercreutzia и Candidatus Saccharimonas ), (3) бактерии с повышенной численностью в группах GX.DG и GX.SG ( Elusimicrobium , [Eubacterium] Ruminococcaceae_UCG-005 ), (4) бактерии, численность которых снизилась только в группе GX.DG ( Lachnospiraceae_NK4A136_group , Lactobacillus и Parasutterella ), (5) бактерии, численность которых увеличилась в группе GX.Группы DG и GX.SG, особенно в группе HB ( Turicibacter и Allobaculum ), и (6) бактерии, численность которых увеличилась в группе GX.SG и уменьшилась в группе GX.DG ( Bifidobacterium ). Анализ показал, что разные роды кишечной микробиоты демонстрируют разные ответы на инфекцию гриппа, причем некоторые общие черты характерны для отдельных родов в зависимости от исхода инфекции. Основываясь на корреляциях между численностью кишечных микробов и состоянием здоровья инфицированных мышей, мы предположили, что Lachnospiraceae_NK4A136_group , Parasutterella , Lactobacillus и Bifidobacterium могут играть важную роль в защите хозяина от инфекции гриппа .
Bifidobacterium pseudolongum и Bifidobacterium animalis сильно связаны с выживаемостью инфицированных гриппом мышейПоскольку приведенный выше таксономический анализ показал, что определенные роды бактерий могут влиять на реакцию хозяина на инфекцию, мы перешли к анализу бактерий на видовой уровень. Соответственно, 177 репрезентативных образцов из всех групп, собранных на 0, 2, 5, 8, 9, 10, 11 и 15 дни после инфицирования, были отобраны для анализов метагеномного секвенирования.Для характеристики богатства генов был проведен анализ разрежения. Оценочные значения богатства генов почти приблизились к насыщению во всех группах, что указывает на то, что данные секвенирования имели достаточный охват и что только очень немногие гены могут быть необнаруженными (дополнительный файл 6: рис. S6). Результаты анализа PCoA показали заметный сдвиг в составе микробиоты кишечника в образцах GX.DG на более поздней стадии инфекции (рис. 3a), что согласуется с результатами анализа секвенирования гена 16S рРНК. Это указывает на то, что исходный набор данных можно использовать для значимого анализа изменений численности бактерий на уровне видов.
Рис. 3Выживаемость инфицированных мышей тесно связана с размножением нескольких видов бактерий. Описание эксперимента ссылается на рис. 2. Из них 177 репрезентативных образцов из всех групп, собранных на 0, 2, 5, 8, 9, 10, 11 и 15 дни после заражения (57 образцов из группы GX.DG и 40 образцов из группы GX.DG и 40 образцы каждого из групп GX.SG, NC и HB) были отобраны для анализа метагеномного секвенирования. — PCoA взвешенных расстояний UniFrac среди GX.Группы DG, GX.SG, HB и NC. b Тепловая карта относительного содержания ЦАГ. c , d Сети совместного возникновения, созданные на основе сравнений группы GX.SG с группами GX.DG ( c ) и NC ( d ). Сеть совместной встречаемости, полученная для каждого образца фекалий в соответствии с корреляциями Спирмена, стратифицирована по типу инфекции. Каждый узел в сети указывает на CAG, а размер узла представляет собой среднее относительное количество одного CAG.Были сохранены только CAG, обогащенные в группе GX.SG по сравнению с группой GX.DG или NC (OR> 2). e ROC-кривая окончательной модели случайного леса, построенная с использованием относительной численности 18 CAG, обогащенных в группе GX.SG, по сравнению с группой GX.DG. Статистика AUC — это сводная мера производительности классификатора. Значения AUC, близкие к 1, указывают на то, что высокая частота истинных положительных результатов была достигнута при низкой частоте ложных срабатываний (идеальная производительность), тогда как значения AUC, близкие к 0,5, указывают на случайную производительность. f Важность переменной в соответствии со средним снижением точности случайного классификатора лесов. Среднее снижение точности, полученное после перестановки переменной, показывает важность переменной с точки зрения ее вклада в точность классификатора случайного леса. Переменные с высоким средним снижением точности больше способствуют классификации данных, чем переменные с низким средним снижением точности. г , ч LEfSe Сравнение кишечных микробов на уровне видов между GX.Группы SG и GX.DG ( г ) и группы GX.SG и NC ( ч ) на 2-й день после инфицирования
Затем мы проанализировали группы генов совместной численности (CAG) всех генов, чтобы выявить любые корреляции между численностью вида и состоянием здоровья хозяина. Всего было идентифицировано 1157 CAG, и 98 из этих групп были аннотированы (дополнительный файл 7: таблица S1). Относительное количество аннотированных CAG в четырех группах мышей показано на рис. 3b. Действительно, ЦАГ, обогащенные группой GX.DG, отличались от таковых в группе NC: в первой наблюдалась большая численность Escherichia coli , Bacteroides , Parabacteroides , Streptococcus agalactiae и Helicobacter . Lactobacillus (CAG этих бактерий перечислены в дополнительном файле 7: Таблица S1).Хотя компоненты CAG в группах GX.SG и HB были очень похожи на компоненты в группе NC, были идентифицированы несколько специфических компонентов. Например, в группе GX.SG было больше B. pseudolongum и B. animalis , а в группе HB — Lachnospiraceae . Для сравнительного анализа групп GX.SG и GX.DG или групп GX.SG и NC ассоциированные с GX.SG CAG были классифицированы как обогащенные в группе GX.SG (оценка отношения шансов (OR)> 2 ).Для дальнейшей идентификации доминирующих специфических видов в группе GX.SG и их корреляции с серьезностью заболевания была создана корреляционная сеть Спирмена для CAG, обогащенных в группе GX.SG (данные за 9-15 дней показаны на рис. 3c, d. ). По сравнению с группой GX.DG, группа GX.SG показала большее количество 18 CAG (рис. 3c), большинство из которых, как ранее было обнаружено, приносят пользу для здоровья [16, 17]. Кроме того, по сравнению с группой NC, группа GX.SG была обогащена 12 CAG (рис.3d), из которых B. animalis (2 CAG) и Clostridium sp. (2 CAG) были использованы в указанной выше корреляционной сети. Это указывает на то, что эти два вида могут играть важную роль (например, защитную роль) во время заражения гриппом. Затем был использован классификатор случайного леса для классификации групп GX.SG и GX.DG с использованием 18 CAG, обогащенных группой GX.SG по сравнению с группой GX.DG. Десятикратная перекрестная проверка была повторена пять раз, и площадь под кривой (AUC) рабочей характеристики приемника (ROC) использовалась в качестве метода оценки для оценки точности классификатора на наборе тестовых данных (рис.3д). На основе набора тестов была получена средняя AUC 85,39% с 95% доверительным интервалом (ДИ) от 76,77 до 94%, что указывает на то, что эта модель обладает мощным диагностическим потенциалом для прогнозирования прогноза / тяжести инфицированных мышей. Более того, вклад каждой CAG оценивался на основе среднего снижения точности (рис. 3f). Среди 18 проанализированных CAG, CAG, обозначенные как B. pseudolongum (CAG-982 и CAG-979), Lactobacillus sp. (CAG947, CAG944, CAG950 и CAG952) и B.animalis (CAG980 и CAG981) внесла наибольший вклад в идентификацию групп GX.SG и GX.DG. Эти данные дополнительно подтвердили тесную корреляцию между выживаемостью инфицированных мышей и присутствием конкретных бактерий, особенно B. pseudolongum , Lactobacillus и B. animalis .
Далее, чтобы получить подробные различия микробиоты кишечника в каждый момент времени, был проведен анализ размера эффекта (LEfSe) линейного дискриминантного анализа (LDA) (рис.3g, h и Дополнительный файл 8: Рис S7). В день 0 после инфицирования численность кишечных микробов не имеет явных различий между группами GX.SG и GX.DG или NC. Однако численность B. pseudolongum и B. animalis , очевидно, была увеличена у мышей GX.SG через 2 дня после заражения по сравнению с их численностью у мышей GX.DG или NC (рис. 3g, h). . Повышенное распределение B. pseudolongum у мышей GX.SG сохранялось на протяжении всего процесса инфицирования, при этом B.animalis также были обнаружены в повышенных уровнях на 10-й и 11-й дни после заражения (дополнительный файл 8: рис. S7). Кроме того, для подтверждения метагеномного анализа была проведена qRT-PCR для обнаружения B. pseudolongum и B. animalis образцов фекалий, собранных в другом повторном эксперименте. Как показано в Дополнительном файле 9: Рис. S8, популяции B. pseudolongum и B. animalis были фактически обогащены GX.SG по сравнению с GX.DG на 2-й и 10-й день после заражения, но не на день 0 после заражения.Они предположили, что различия в численности B. pseudolongum и B. animalis между группами GX.DG и GX.SG были связаны с дифференциальными ответами этих мышей на инфекцию гриппа, а не из-за различий в начальные количества этих кишечных микробов.
Основано на объективном законе причинно-следственной связи в причинно-следственной связи, а также на описанных выше экспериментах FMT и характеристиках распределения кишечных микробов в GX.Группа SG, мы предположили, что микробиота кишечника увеличивает устойчивость мыши-хозяина к вирулентной инфекции вируса H7N9 за счет увеличения количества эндогенных B. pseudolongum и / или B. animalis .
Пищевой зонд для микробов, связанных с выживанием, защищает хозяина от гриппа
Чтобы проверить роль B. pseudolongum и B. animalis в устойчивости хозяина к инфекции гриппа, мышей SPF лечили раствором антибиотика (ATB) [ 18], а затем вводили два бактериальных штамма (по одному или в комбинации) через желудочный зонд до инфицирования.Пероральное введение одного только B. animalis или комбинации двух бактерий значительно увеличивало выживаемость мышей-реципиентов, но введение через желудочный зонд только B. pseudolongum не имело очевидного эффекта (фиг. 4a). Кроме того, потеря веса наиболее отчетливо улучшилась на 6-10 дни после заражения через желудочный зонд комбинацией двух бактерий и несколько улучшилась через желудочный зонд только с B. animalis (фиг. 4b). Чтобы устранить любые возможные артефакты (например, остаточную микрофлору), связанные с обработанными ATB мышами, мышам, очищенным от микробов, перорально вводили B.animalis отдельно, комбинация двух бактерий или PBS. Точно так же введение через желудочный зонд только с B. animalis и комбинацией двух бактерий значительно увеличивало выживаемость стерильных мышей. Единственное различие состоит в том, что для стерильных мышей введение только B. animalis обеспечивало почти такую же защиту, как и комбинированный желудочный зонд, но у мышей, предварительно обработанных ATB, было только половину защиты через желудочный зонд с B. animalis. по сравнению с комбинированным желудочным зондом (рис.4в). Эти наблюдения продемонстрировали, что перенос B.pseudolongum сам по себе обеспечивает очевидную защиту от гриппа и что эта защита может быть усилена дополнительным введением B. pseudolongum нестерильным мышам.
Рис. 4Пероральное введение микробов, связанных с выживанием, защищает реципиента от вирулентной инфекции вируса H7N9. Выживаемость ( a ) и потеря веса ( b ) мышей, получавших раствор антибиотика (ATB), которым вводили микробы, связанные с выживанием, или PBS, а затем инфицировали GX ( n = 20 мышей на группу).Введенные микробы представляли собой только B. pseudolongum , B. animalis отдельно или комбинацию B. pseudolongum и B. animalis . Значительная разница в изменениях веса ( P <0,05) наблюдалась только между групповым комбинированным желудочным зондом и PBS через желудочный зонд на 3, 7 и 8 дни. c Выживаемость стерильных мышей, которым вводили B. animalis отдельно ( n = 6), комбинацию двух бактерий ( n = 7) или PBS ( n = 6), а затем инфицировали GX.Титры вирусов ( d ), концентрации цитокинов ( e ) и гистологическое исследование (окрашивание H&E) ( f ) легких мышей, предварительно обработанных ATB, после инфицирования GX. Перед инфицированием предварительно обработанным ATB мышам вводили только B. pseudolongum , только B. animalis , комбинацию двух бактерий или PBS, по 15 мышей в каждой группе. Пять мышей из каждой группы были случайным образом умерщвлены для взятия легких на 0, 3 и 5 дни после инфицирования.Гомогенат легких готовили для определения титров вирусов и концентраций цитокинов. Кроме того, 24 мыши, предварительно обработанные ATB, случайным образом делили на четыре группы и лечили, как описано выше. В дни 0 и 7 после инфицирования случайным образом умерщвляли по 3 мыши на группу. Легкие собраны для гистологического исследования. Показаны репрезентативные изображения. Данные представлены как среднее значение ± стандартное отклонение. Статистические данные об изменениях веса, титрах вирусов и концентрации цитокинов представляли собой двухфакторный дисперсионный анализ.* P <0,05, ** P <0,01. Статистические данные в анализе выживаемости проводились с использованием логарифма (Mantel-Cox). Все эксперименты проводились по крайней мере дважды в одинаковых условиях и дали аналогичные результаты.
Параллельный эксперимент с участием мышей, предварительно обработанных ATB, как описано выше, был проведен для определения титра легочного вируса и уровней цитокинов, а также для изучения гистологических изменений. На 3-й и 5-й дни после инфицирования титры вируса легких у мышей, которым вводили B.animalis отдельно или комбинация двух бактерий были значительно ниже, чем у мышей, получавших PBS (фиг. 4d). Однако уровни цитокинов в легких мышей, которым вводили только B. animalis или комбинацию двух бактерий, показали разные тенденции между двумя временными точками по сравнению с уровнями у мышей, которым вводили PBS (фиг. 4e): уровни большинство тестируемых цитокинов было значительно повышено в легких мышей, которым вводили только B. animalis или комбинацию двух бактерий на 3 день после инфицирования; Напротив, на 5 день после инфицирования уровни нескольких цитокинов в этих двух группах, особенно в группе с комбинацией двух бактерий, стали ниже, чем у мышей, получавших PBS.Хотя только уровни IL-6 значительно снизились в крови мышей, которым вводили только B. animalis и комбинацию двух бактерий на 5-й день после инфицирования, большинство цитокинов демонстрировали очевидное увеличение в этих двух группах на 3-й день после инфицирования. (Дополнительный файл 10: Рис. S9). Данные показали, что более низкие титры вируса легких у мышей, которым вводили только B. animalis или комбинацию двух бактерий, по сравнению с таковыми у мышей, которым вводили PBS, сопровождались большей индукцией цитокинов на ранней фазе инфекции H7N9.Это предполагает, что B. animalis , вероятно, защищает хозяев от инфекции гриппа, модулируя иммунный ответ хозяина.
Кроме того, гистологическое исследование показало, что в легких мышей, которым вводили только PBS или B. pseudolongum , на 7 день после инфицирования наблюдались тяжелые патологии, включая застой, инфильтрацию воспалительных клеток и молочные клетки в просвете бронхов, даже альвеолы почти исчезли. Напротив, поражения легких у мышей, которым вводили B.Animalis отдельно или комбинация двух бактерий были явно улучшены (фиг. 4f). Это дополнительно подтвердило противогриппозный эффект B. animalis .
B. animalis способствует определенным метаболическим функциям микробиома кишечника для защиты хозяина от инфекции гриппаЧтобы лучше понять механизм, посредством которого B. animalis опосредует противогриппозный эффект, мы провели функциональное сравнение метагенома микробиом кишечника между GX.SG и GX.DG или группы NC. В целом, 2278 терминов KEGG Orthology (KO) были обогащены в группе GX.SG по сравнению с группами GX.DG или NC (дополнительный файл 11: таблица S2). Характеристики распределения этих членов КО в каждый момент времени показаны на рис. 5а. Сравнение групп GX.SG и GX.DG выявило обогащение терминов KO в группе GX.SG в основном на ранних и поздних стадиях заражения. Однако при сравнении групп GX.SG и NC термины KO, обогащенные в группе GX.SG, в основном наблюдались на ранней и средней стадиях заражения.Кроме того, количество обогащенных KO-членов в первом сравнении (1606) было явно выше, чем во втором сравнении (1061). Это свидетельствует о том, что функциональная структура микробиоты кишечника в группе GX.SG была больше похожа на таковую в группе NC.
Рис. 5Функциональное метагеномное сравнение микробиома кишечника в разных группах мышей показывает, что B. animalis может опосредовать защитный эффект против гриппа посредством определенных метаболических путей. a Распределение всех терминов KO, обогащенных в группе GX.SG по сравнению с группой GX.DG или NC. Желтым цветом обозначены KO-термины, не относящиеся ни к B. animalis , ни к B. pseudolongum ; зеленый цвет обозначает KO-термины, относящиеся к B. animalis , но не к B. pseudolongum ; красным цветом обозначены KO-термины, относящиеся к B. pseudolongum , но не к B. animalis ; синим цветом обозначены термины KO, относящиеся как к B.animalis и B. pseudolongum . b Функциональный состав терминов KO, обогащенный на 2-й день после инфицирования в группе GX.SG по сравнению с группами GX.DG и NC, и вклад B. animalis или B. pseudolongum в эти функции. Показаны только термины KO, помеченные номером модуля (M).
Кроме того, обогащенные метаболические пути в группе GX.SG выявлены путем сравнений между группами GX.SG и GX.DG, а также между группами GX.Группы SG и NC продемонстрировали характеристики распределения, аналогичные тем, которые были обнаружены при анализе терминов KO (дополнительный файл 12: рис. S10). Что еще более важно, на 2-й и 5-й дни после заражения многие термины KO были обогащены в группе GX.SG по сравнению с группами GX.DG и NC (дважды положительные обогащенные термины KO) (рис. 5a), что подразумевает эти KO термины, скорее всего, играют важную роль в защите от гриппа. Наши данные выше продемонстрировали, что B. animalis был значительно обогащен GX.SG мышей через 2 дня после заражения по сравнению с мышами GX.DG или NC, но не через 5 дней после заражения (рис. 3g, h и дополнительный файл 8: рис. S7), что позволяет предположить, что B. animalis обеспечивает больше противогриппозный эффект через 2 дня после заражения, чем через 5 дней. Таким образом, мы впоследствии проанализировали функциональный состав дважды положительных обогащенных KO-терминов через 2 дня после заражения и вклад B. animalis в эти термины / функции. Как показано на рис. 5b, 39 функций были идентифицированы среди дважды положительных обогащенных терминов KO (здесь были показаны только термины KO, помеченные номером модуля; другие термины KO без номера модуля были перечислены в дополнительном файле 11: Таблица S2) , который включает пять путей, включая метаболизм углеводов и липидов, энергетический метаболизм, обработку информации об окружающей среде, обработку генетической информации и метаболизм нуклеотидов и аминокислот. B. animalis или B. pseudolongum участвует в большинстве из этих 39 функций и во всех пяти путях. Из этих путей биосинтез валина / изолейцина (M00019), биосинтез лизина и путь дегидрогеназы DAP (M00526) и биосинтез кофермента A (CoA) (M00120) уникально обогащены B. animalis . Эти результаты показали, что B. animalis может опосредовать защитный эффект против гриппа за счет стимуляции биосинтеза валина, изолейцина, лизина и КоА.
Пероральное введение валина или внутрибрюшинная инъекция КоА защищает хозяина от гриппа
Для проверки вышеуказанного функционального метагеномного анализа мышам, предварительно обработанным ATB, вводили через зонд валин, изолейцин или лизин или внутрибрюшинно вводили КоА, а затем интраназально заражен вирусом H7N9. Как показано на фиг. 6a, b, f, g, пероральное введение валина или внутрибрюшинная инъекция CoA значительно увеличивают выживаемость мышей-реципиентов и улучшают потерю веса.Напротив, пероральное введение лизина только улучшило потерю веса, а пероральное введение изолейцина не имело никакого эффекта. Эти результаты продемонстрировали, что пероральное введение валина или внутрибрюшинная инъекция КоА может обеспечить защиту от гриппа in vivo. Однако in vitro и валин, и КоА не показали очевидного противогриппозного действия в клетках A549 (дополнительный файл 13: Рис. S11), что позволяет предположить, что противогриппозные эффекты валина и КоА могут быть косвенными. Чтобы лучше понять, как валин и КоА опосредуют противогриппозный эффект in vivo, были проведены параллельные эксперименты на животных.Затем легкие собирали для определения титра вируса, уровней цитокинов и гистологических изменений (рис. 6c – e, h – j). На 5-й день после инфицирования как пероральное введение валина, так и внутрибрюшинная инъекция КоА могут значительно снизить титры вируса и уровни IL-1β, IL-6 и IL-10 в легких и в то же время повысить регуляцию IFN-β и IFN-γ легких. Кроме того, на 7-й день после инфицирования обработка как валином, так и КоА также уменьшала поражение легких по сравнению с лечением PBS. Разница в том, что в день 0 после инфицирования внутрибрюшинная инъекция КоА, очевидно, может индуцировать экспрессию TNF-α, IL-1β, IL-6 и IFN-γ в легких, но пероральное введение валина только стимулирует IFN. -γ.Эти данные предполагают, что противогриппозный эффект валина может быть обусловлен его иммунорегуляторными свойствами после заражения гриппом, в отличие от КоА, поскольку он заранее стимулирует врожденный иммунный ответ.
Рис. 6Пероральное введение валина или внутрибрюшинная инъекция КоА защищают мышей-реципиентов от инфицирования вирулентным вирусом H7N9. Выживаемость ( a ) и потеря веса ( b ) мышей, которым перорально вводили (перорально) ежедневно в течение 1 недели 100 мг валина, изолейцина или лизина или того же объема PBS (200 мкл), а затем инфицировали. с вирусом гриппа H7N9 GX ( n = 10 мышей на группу).** P <0,01 (валин по сравнению с PBS), ## P <0,01 (лизин по сравнению с PBS). Титры вируса ( c ), концентрации цитокинов ( d ) и гистологическое исследование (окрашивание H&E) ( e ) легких мышей, предварительно обработанных валином, после инфицирования вирусом GX. * P <0,05, ** P <0,01 (валин по сравнению с PBS). Выживаемость ( f ) и потеря веса ( г ) мышей, которым внутрибрюшинно вводили инъекцию (i.п.) ежедневно в течение 3 дней с 0,2 мг КоА или того же объема PBS (100 мкл), а затем инфицировали вирусом гриппа H7N9 GX ( n = 10 мышей на группу). * P <0,05 (CoA по сравнению с PBS). Титры вируса ( h ), концентрации цитокинов ( i ) и гистологическое исследование (окрашивание H&E) ( j ) легких мышей, предварительно обработанных CoA, после инфицирования вирусом GX. * P <0,05, ** P <0,01 (CoA по сравнению с PBS). В каждый момент времени по 5 мышей на группу для определения титров вирусов и концентраций цитокинов и по 3 мыши на группу для гистологического исследования.Статистические данные в анализе выживаемости проводились с использованием логарифма (Mantel-Cox). Статистические данные по изменениям веса и концентрации цитокинов представляли собой двухфакторный дисперсионный анализ. Статистика по титру вируса составила t проб. Данные представлены как среднее значение ± стандартное отклонение. Для гистологического исследования показаны репрезентативные изображения. Все эксперименты проводились как минимум дважды в одинаковых условиях и дали аналогичные результаты
Польза для здоровья, побочные эффекты, применение, доза и меры предосторожности
Абэ, Ф., Muto, M., Yaeshima, T., Iwatsuki, K., Aihara, H., Ohashi, Y., and Fujisawa, T. Оценка безопасности пробиотических бифидобактерий путем анализа активности деградации муцина и способности к транслокации. Анаэроб. 2010; 16 (2): 131-136. Просмотр аннотации.
Акацу, Х., Ивабути, Н., Сяо, Дж. З., Мацуяма, З., Курихара, Р., Окуда, К., Ямамото, Т., и Маруяма, М. Клинические эффекты пробиотических бактерий Bifidobacterium longum BB536 на иммунную систему. Функция и кишечная микробиота у пожилых пациентов, получающих энтеральное зондовое питание.JPEN J Parenter Enteral Nutr 11-27-2012; Просмотр аннотации.
Андраде, С. и Борхес, Н. Влияние ферментированного молока, содержащего Lactobacillus acidophilus и Bifidobacterium longum, на липиды плазмы женщин с нормальным или умеренно повышенным холестерином. J.Dairy Res. 2009; 76 (4): 469-474. Просмотр аннотации.
Арая-Кодзима Томоко, Яэшима Томоко Исибаши Норио Симамура Сейичи Хаясава Хиротоши. Ингибирующее действие Bifidobacterium longum BB536 на вредные кишечные бактерии. Бифидобактерии Microflora 1995; 14 (2): 59-66.
Ballongue J, Grill J Baratte-Euloge P. Экшн по цвету кишечных ферментов с бифидобактериями. Lait 1993; 73: 249-256.
Беннет Р., Норд К. Э. и Зеттерстром Р. Временная колонизация кишечника новорожденных младенцев перорально вводимыми бифидобактериями и лактобактериями. Acta Paediatr. 1992; 81 (10): 784-787. Просмотр аннотации.
Берцик, П., Парк, А. Дж., Синклер, Д., Хошдел, А., Лу, Дж., Хуанг, X., Дэн, Ю., Бленнерхассет, П. А., Фанесток, М., Мойн, Д., Berger, B., Huizinga, J. D., Kunze, W., McLean, P. G., Bergonzelli, G. E., Collins, S. M. и Verdu, E. F. Анксиолитический эффект Bifidobacterium longum NCC3001 затрагивает вагусные пути для связи кишечника и мозга. Нейрогастроэнтерол.Мотил. 2011; 23 (12): 1132-1139. Просмотр аннотации.
Challa, A., Rao, D. R., Chawan, C. B. и Shackelford, L. Bifidobacterium longum и лактулоза подавляют индуцированные азоксиметаном аберрантные очаги крипт толстой кишки у крыс. Канцерогенез 1997; 18 (3): 517-521. Просмотр аннотации.
Chouraqui, JP, Grathwohl, D., Labaune, JM, Hascoet, JM, de, Montgolfier, I, Leclaire, M., Giarre, M., and Steenhout, P. Оценка безопасности, переносимости и защитного эффекта против диареи смесей для младенцев, содержащих смеси пробиотиков или пробиотиков и пребиотиков, в рандомизированном контролируемом исследовании. Am.J Clin.Nutr. 2008; 87 (5): 1365-1373. Просмотр аннотации.
Crociani, J., Grill, J. P., Huppert, M. и Ballongue, J. Адгезия различных штаммов бифидобактерий к человеческим энтероцитоподобным клеткам Caco-2 и сравнение с исследованием in vivo.Lett.Appl.Microbiol. 1995; 21 (3): 146-148. Просмотр аннотации.
Дас Р.Р. Сингх М., Шафик Н. Пробиотики в лечении аллергического ринита. Журнал Всемирной организации аллергии 2010; 3 (9): 239-244.
del Giudice, M. M. и Brunese, F. P. Пробиотики, пребиотики и аллергия у детей: что нового за последний год? J Clin.Gastroenterol. 2008; 42 Приложение 3, часть 2: S205-S208. Просмотр аннотации.
Фирмансьях, А., Двапурванторо, П. Г., Кадим, М., Алатас, С., Конус, Н., Лестарина, Л., Буассе, Ф., и Steenhout, P. Улучшение роста малышей, которых кормили молоком, содержащим синбиотики. Азия Pac.J Clin.Nutr. 2011; 20 (1): 69-76. Просмотр аннотации.
Джанотти, Л., Морелли, Л., Гальбиати, Ф., Роккетти, С., Коппола, С., Бенедуче, А., Джилардини, К., Зоненсчейн, Д., Несполи, А., и Брага, M. Рандомизированное двойное слепое исследование периоперационного введения пробиотиков пациентам с колоректальным раком. Мир Дж. Гастроэнтерол. 1-14-2010; 16 (2): 167-175. Просмотр аннотации.
Grill, J. P., Manginot-Durr, C., Schneider, F., и Ballongue, J. Бифидобактерии и пробиотические эффекты: действие видов Bifidobacterium на конъюгированные соли желчных кислот. Curr.Microbiol. 1995; 31 (1): 23-27. Просмотр аннотации.
Grzeskowiak, L., Gronlund, MM, Beckmann, C., Salminen, S., von, Berg A. и Isolauri, E. Влияние перинатального пробиотического вмешательства на микробиоту кишечника: двойные слепые плацебо-контролируемые испытания в Финляндия и Германия. Анаэроб. 2012; 18 (1): 7-13. Просмотр аннотации.
Хаскоет, Дж. М., Хьюберт, К., Роша, Ф., Legagneur, H., Gaga, S., Emady-Azar, S. и Steenhout, P. G. Влияние состава смеси на развитие микробиоты кишечника младенца. J Педиатр, гастроэнтерол, питание. 2011; 52 (6): 756-762. Просмотр аннотации.
Игараси М., Иияма И Като Р. Томита М. Асами Н. Эзава И. Влияние Bifidobacterium longum и лактулозы на прочность кости в моделях остеопороза после овариэктомии. Бифид 1994; 7: 139-147.
Ишизеки, С. Сугита М. Таката М. и Яешима Т. Изучение эффектов введения бифидобактерий на микрофлору кишечника у младенцев с низкой массой тела при рождении: эффекты введения трех видов бифидобактерий.Журнал Японского педиатрического общества 2004; 108: 283.
Ивабучи Н., Хирута Н. Канетада С. Яешима Т. Ивацуки К. Ясуи Х. Влияние интраназального введения Bifidobacterium longum BB536 на иммунную систему слизистой оболочки дыхательных путей и вирусную инфекцию гриппа у мышей. Наука о молоке 2009; 38 (3): 129-133.
Ивабучи, Н., Такахаши, Н., Сяо, Дж. З., Мияджи, К. и Ивацуки, К. In vitro Th2-независимые цитокин-независимые Th3 подавляющие эффекты бифидобактерий. Microbiol.Immunol.2007; 51 (7): 649-660. Просмотр аннотации.
Ивабути, Н., Такахаши, Н., Сяо, Дж. З., Йонедзава, С., Яэшима, Т., Ивацуки, К., и Хачимура, С. Подавляющее действие Bifidobacterium longum на производство Th3-привлекающих хемокинов индуцировало с взаимодействиями Т-лимфоцитов с антиген-презентирующими клетками. FEMS Immunol.Med.Microbiol. 2009; 55 (3): 324-334. Просмотр аннотации.
Iwabuchi, N., Xiao, J. Z., Yaeshima, T., and Iwatsuki, K. Пероральное введение Bifidobacterium longum уменьшает инфекцию вируса гриппа у мышей.Биол.Фарм.Булл. 2011; 34 (8): 1352-1355. Просмотр аннотации.
Кабейр Б. М., Язид А. М., Стефани В., Хаким М. Н., Анас О. М. и Шухайми М. Оценка безопасности Bifidobacterium pseudocatenulatum G4 по оценке на мышах BALB / c. Lett.Appl.Microbiol. 2008; 46 (1): 32-37. Просмотр аннотации.
Кагеяма Т., Накано и Томода Т. Сравнительное исследование перорального приема некоторых препаратов бифидобактерий. Медицина и биология (Япония) 1987; 115 (2): 65-68.
Кагеяма Т., Томода Т. Накано Ю.Эффект от введения бифидобактерий у больных лейкемией. Бифидобактерии Microflora. 1984; 3 (1): 29-33.
Кондо, Дж., Сяо, Дж. З., Сирахата, А., Баба, М., Абэ, А., Огава, К., и Симода, Т. Модулирующие эффекты Bifidobacterium longum BB536 на дефекацию у пожилых пациентов, получающих энтеральное питание . Всемирный журнал J Gastroenterol 4-14-2013; 19 (14): 2162-2170. Просмотр аннотации.
Кулькарни Н. и Редди Б. С. Ингибирующее действие культур Bifidobacterium longum на индуцированное азоксиметаном образование аберрантных очагов крипт и фекальную бактериальную бета-глюкуронидазу.Proc.Soc Exp.Biol.Med 1994; 207 (3): 278-283. Просмотр аннотации.
Mah, KW, Chin, VI, Wong, WS, Lay, C., Tannock, GW, Shek, LP, Aw, MM, Chua, KY, Wong, HB, Panchalingham, A., and Lee, B.W. Влияние молочная смесь, содержащая пробиотики для фекальной микробиоты азиатских младенцев с риском атопических заболеваний. Педиатр. 2007; 62 (6): 674-679. Просмотр аннотации.
Макрас, Л. Де Вуйст Л. Ингибирование бифидобактериями грамотрицательных патогенных бактерий in vitro вызвано производством органических кислот.Международный молочный журнал 2006; 16: 1049-1057.
Мацумото, Т., Исикава, Х., Татеда, К., Яэшима, Т., Ишибаши, Н. и Ямагути, К. Пероральное введение Bifidobacterium longum предотвращает вызванный кишечником сепсис Pseudomonas aeruginosa у мышей. J Appl.Microbiol. 2008; 104 (3): 672-680. Просмотр аннотации.
Momose H, Igarashi M Era T Fukuda Y Yamada M и Ogasa K. Токсикологические исследования Bifidobacterium longum BB536. Ойо якури 1979; 17 (5): 881-887.
Намба К., Яешима Т. Ишибаши Н. Хаясава Х и Ямадзаки Сёдзи.Ингибирующее действие Bifidobacterium longum на энтерогеморрагическую Escherichia coli O157: H7. Биологическая микрофлора 2003; 22 (3): 85-91.
Намба К., Хатано М., Яешима Т., Такасе М. и Сузуки К. Влияние введения Bifidobacterium longum BB536 на гриппозную инфекцию, титр антител к вакцине против гриппа и клеточный иммунитет у пожилых людей . Biosci.Biotechnol.Biochem. 2010; 74 (5): 939-945. Просмотр аннотации.
Odamaki, T., Sugahara, H., Yonezawa, S., Yaeshima, T., Iwatsuki, K., Tanabe, S., Tominaga, T., Togashi, H., Benno, Y., и Xiao, J. Z. Влияние перорального приема йогурта, содержащего Bifidobacterium longum BB536, на количество клеток энтеротоксигенных Bacteroides fragilis в микробиоте. Анаэроб. 2012; 18 (1): 14-18. Просмотр аннотации.
Odamaki, T., Xiao, JZ, Iwabuchi, N., Sakamoto, M., Takahashi, N., Kondo, S., Iwatsuki, K., Kokubo, S., Togashi, H., Enomoto, T. , и Бенно, Ю. Колебания фекальной микробиоты у людей с поллинозом японского кедра во время сезона пыльцы и влияние приема пробиотиков.J Investig.Allergol.Clin.Immunol. 2007; 17 (2): 92-100. Просмотр аннотации.
Odamaki, T., Xiao, JZ, Iwabuchi, N., Sakamoto, M., Takahashi, N., Kondo, S., Miyaji, K., Iwatsuki, K., Togashi, H., Enomoto, T. , и Бенно, Ю. Влияние потребления Bifidobacterium longum BB536 на фекальную микробиоту у людей с поллинозом японского кедра в сезон пыльцы. J Med.Microbiol. 2007; 56 (Pt 10): 1301-1308. Просмотр аннотации.
Одамаки, Т., Сяо, Дж. З., Сакамото, М., Кондо, С., Яешима, Т., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Распространение различных видов группы Bacteroides fragilis у лиц с поллинозом японского кедра. Appl.Environ.Microbiol. 2008; 74 (21): 6814-6817. Просмотр аннотации.
Огата Т., Кингаку М. Яэшима Т. Терагути С. Фукуватари и Ишибаши Н. Хаясава Х. Фудзисава Т. Лино Х. Влияние приема йогурта Bifidobacterium longum BB536 на кишечную среду здоровых взрослых. Microb Ecol Health Dis 1999; 11: 41-46.
Ogata T, Nakamura T Anjitsu K Yaeshima T Takahashi S Fukuwatari Y Ishibashi N Hayasawa H Fujisawa T Iino H.Влияние введения Bifidobacterium longum BB536 на кишечную среду, частоту дефекации и фекальные характеристики людей-добровольцев. Biosci Microflora 1997; 16: 53-58.
Орраге, К., Шостедт, С., и Норд, С. E. Влияние добавок с молочнокислыми бактериями и олигофруктозой на микрофлору кишечника во время приема цефподоксима проксетила. J Antimicrob.Chemother. 2000; 46 (4): 603-612. Просмотр аннотации.
Пуччо, Г., Кахоццо, К., Мели, Ф., Роша, Ф., Grathwohl, D., and Steenhout, P. Клиническая оценка новой закваски для младенцев, содержащей живые Bifidobacterium longum BL999 и пребиотики. Питание 2007; 23 (1): 1-8. Просмотр аннотации.
Редди Б. С. и Ривенсон А. Ингибирующее действие Bifidobacterium longum на канцерогенез толстой кишки, молочной железы и печени, индуцированный 2-амино-3-метилимидазо [4,5-f] хинолином, пищевым мутагеном. Cancer Res. 9-1-1993; 53 (17): 3914-3918. Просмотр аннотации.
Rouge, C., Piloquet, H., Butel, M. J., Berger, B., Rochat, F., Ferraris, L., Des, Robert C., Legrand, A., de la Cochetiere, MF, N’Guyen, JM, Vodovar, M., Voyer, M., Darmaun, D., and Roze, JC Пероральные добавки с пробиотиками для недоношенных новорожденных с очень низкой массой тела при рождении: рандомизированное, двойное слепое, плацебо-контролируемое исследование. Am.J Clin.Nutr. 2009; 89 (6): 1828-1835. Просмотр аннотации.
Секи М., Игараси Т. Фукуда И Симамура С Касвашима Т. Огаса К. Влияние кисломолочного продукта Bifidobacterium на «регулярность» среди пожилых людей. Nutr Foodstuff 1978; 31: 379-387.
Sekine I, Yoshiwara S Homma N Takanori H Tonosuka S. Влияние молока, содержащего бифидобактерии, на хемилюминесцентную реакцию периферических лейкоцитов и средний корпускулярный объем эритроцитов — возможная роль Bifidobacterium в активации макрофагов. Therapeutics (Япония) 1985; 14: 691-695.
Секин К., Кавашима Т. и Хашимото Ю. Сравнение уровней TNF-a, индуцированных Bifidobacterium longum, полученными от человека, и Bifidobacterium animalis, полученными от крысы, в перитонеальных клетках мышей.Бифидобактерии Microflora 1994; 13 (2): 79-89.
Simakachorn, N., Bibiloni, R., Yimyaem, P., Tongpenyai, Y., Varavithaya, W., Grathwohl, D., Reuteler, G., Maire, JC, Blum, S., Steenhout, P. , Benyacoub, J., и Schiffrin, EJ. Толерантность, безопасность и влияние на фекальную микробиоту энтеральной смеси, дополненной пре- и пробиотиками, у детей в критическом состоянии. J Педиатр, гастроэнтерол, питание. 2011; 53 (2): 174-181. Просмотр аннотации.
Сингх, Дж., Ривенсон, А., Томита, М., Шимамура, С., Ishibashi, N., and Reddy, B. S. Bifidobacterium longum, кишечная бактерия, продуцирующая молочную кислоту, ингибирует рак толстой кишки и модулирует промежуточные биомаркеры канцерогенеза толстой кишки. Канцерогенез 1997; 18 (4): 833-841. Просмотр аннотации.
Soh, SE, Aw, M., Gerez, I., Chong, YS, Rauff, M., Ng, YP, Wong, HB, Pai, N., Lee, BW, and Shek, LP Пробиотические добавки в первые 6 месяцев жизни у азиатских младенцев из группы риска — влияние на экзему и атопическую сенсибилизацию в возрасте 1 года.Клинический опыт аллергии 2009; 39 (4): 571-578. Просмотр аннотации.
Тахри К., Кроциани Дж., Баллонге Дж. И Шнайдер Ф. Воздействие трех штаммов бифидобактерий на холестерин. Lett.Appl.Microbiol. 1995; 21 (3): 149-151. Просмотр аннотации.
Takahashi, N., Kitazawa, H., Iwabuchi, N., Xiao, J. Z., Miyaji, K., Iwatsuki, K., and Saito, T. Иммуностимулирующий олигодезоксинуклеотид из Bifidobacterium longum подавляет иммунные ответы Th3 на мышиной модели. Clin.Exp.Immunol. 2006; 145 (1): 130-138.Просмотр аннотации.
Takahashi, N., Kitazawa, H., Iwabuchi, N., Xiao, JZ, Miyaji, K., Iwatsuki, K., and Saito, T. Пероральное введение иммуностимулирующей последовательности ДНК из Bifidobacterium longum улучшает Th2 / Th3 баланс в мышиной модели. Biosci.Biotechnol.Biochem. 2006; 70 (8): 2013-2017. Просмотр аннотации.
Takahashi, N., Kitazawa, H., Shimosato, T., Iwabuchi, N., Xiao, JZ, Iwatsuki, K., Kokubo, S., and Saito, T. Иммуностимулирующая последовательность ДНК из пробиотического штамма Bifidobacterium longum подавляет выработку IgE in vitro.FEMS Immunol.Med.Microbiol. 2006; 46 (3): 461-469. Просмотр аннотации.
Takeda, Y., Nakase, H., Namba, K., Inoue, S., Ueno, S., Uza, N., and Chiba, T. Улучшается регуляция T-bet и молекул плотных контактов с помощью Bifidobactrium longum воспаление толстой кишки при язвенном колите. Воспаление. 2009; 15 (11): 1617-1618. Просмотр аннотации.
Тан, М. Л., Лахтинен, С. Дж., И Бойл, Р. Дж. Пробиотики и пребиотики: клинические эффекты при аллергических заболеваниях. Curr.Opin.Pediatr. 2010; 22 (5): 626-634.Просмотр аннотации.
Томода Т., Накано Ю. Кагеяма Т. Разрастание кишечных Candida и кандидозная инфекция у пациентов с лейкемией: эффект от введения бифидобактерий. Бифидобактерии Microflora 1988; 7 (2): 71-74.
Томода Т., Накано Ю. Кагеяма Т. Вариации в небольших группах постоянной кишечной флоры во время приема противоопухолевых или иммунодепрессивных препаратов. Медицина и биология (Япония) 1981; 103 (1): 45-49.
Томода, Т. Накано Ю. и Кагеяма Т. Вариация и прилипание видов бифидобактерий в кишечнике при пероральном введении бифидобактерий.Медицина и биология (Япония) 1986; 113 (2): 125-128.
Сяо Дж., Кондол С. Одамаки Т. Мияджи К. Яэшима Т. Ивацуки К. Тогаши Х Бенно Й. Влияние йогурта, содержащего Bifidobacterium longum BB 536, на частоту дефекации и фекальные характеристики здоровых взрослых: двойное слепое перекрестное исследование. Японский журнал молочнокислых бактерий 2007; 18 (1): 31-36.
Xiao, JZ, Kondo, S., Takahashi, N., Odamaki, T., Iwabuchi, N., Miyaji, K., Iwatsuki, K., and Enomoto, T. Изменения уровней TARC в плазме во время пыльцы японского кедра сезон и связь с развитием симптомов.Int.Arch.Allergy Immunol. 2007; 144 (2): 123-127. Просмотр аннотации.
Xiao, JZ, Kondo, S., Yanagisawa, N., Miyaji, K., Enomoto, K., Sakoda, T., Iwatsuki, K., and Enomoto, T. Клиническая эффективность пробиотика Bifidobacterium longum для лечения симптомов аллергии на пыльцу японского кедра у субъектов, оцениваемых в отделении воздействия окружающей среды. Аллергол. 2007; 56 (1): 67-75. Просмотр аннотации.
Сяо, Дж. З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Ивацуки, К., Кокубо, С., Тогаши, Х., Эномото, К., и Эномото, Т. Эффект пробиотика Bifidobacterium longum BB536 [исправленный] в облегчении клинических симптомов и модуляции уровней цитокинов в плазме при поллинозе японского кедра в сезон пыльцы. Рандомизированное двойное слепое плацебо-контролируемое исследование. J Investig.Allergol.Clin.Immunol. 2006; 16 (2): 86-93. Просмотр аннотации.
Сяо, Дж. З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Миядзи, К., Ивацуки, К., Тогаши, Х., Эномото, К., и Эномото, Т. Пробиотики в лечении поллиноза японского кедра: двойное слепое плацебо-контролируемое исследование. Клинический опыт аллергии 2006; 36 (11): 1425-1435. Просмотр аннотации.
Яешима Т., Такахаши С. Мацумото Н. Исибаши Н. Хаясава Х. Лино Х. Влияние йогурта, содержащего Bifidobacterium longum BB536, на кишечную среду, фекальные характеристики и частоту дефекации: сравнение со стандартным йогуртом. Biosci Microflora 1997; 16: 73-77.
Yaeshima T, Takahashi S Ogura A Konno T Iwatsuki K Ishibashi N Hayasawa H.Влияние неферментированного молока, содержащего Bifidobacterium longum BB536, на частоту дефекации и характеристики кала у здоровых взрослых. Журнал Nutrition Food 2001; 4 (2): 1-6.
Яешима Т., Такахаси С Ота С. Накагава К. Ишибаши Н Хирамацу А Охаши Т. Хаясава Х Иино Х. Влияние сладкого йогурта, содержащего Bifidobacterium longum BB536, на частоту дефекации и фекальные характеристики здоровых взрослых людей: сравнение со сладким стандартным йогуртом. Kenko Eiyo Shokuhin Kenkyu 1998; 1 (3/4): 29-34.
Ямазаки, С., Мачии, К., Цуюки, С., Момосе, Х., Кавашима, Т. и Уэда, К. Иммунологические реакции на моноассоциированные Bifidobacterium longum и их связь с предотвращением бактериальной инвазии. Иммунология 1985; 56 (1): 43-50. Просмотр аннотации.
Yap GC, Mah KW Lay C Shek LPC Aw M Chua KY Tannock GW Lee BW. Выявление фекальных Bifidobacterium infantis на первом году жизни у младенцев с риском атопии, получавших Lactobacillus rhamnosus GG и Bifidobacterium longum от рождения до 6 месяцев.Журнал Всемирной организации аллергии. 2007; WAC 2007 Abstracts S130.
Зивковиц, М., Фекаду, К., Зонтаг, Г., Набингер, У., Хубер, У.В., Кунди, М., Чакраборти, А., Фуасси, Х., и Кнасмюллер, С. Предотвращение образования гетероциклических аминов -индуцированное повреждение ДНК в толстой кишке и печени крыс различными штаммами лактобацилл. Канцерогенез 2003; 24 (12): 1913-1918. Просмотр аннотации.
АльФалех К., Анабрис Дж., Басслер Д., Аль-Харфи Т. Пробиотики для профилактики некротического энтероколита у недоношенных детей.Кокрановская база данных систематических обзоров 2011 г., выпуск 3. Ст. №: CD005496. DOI: 10.1002 / 14651858.CD005496.pub3. Просмотр аннотации.
Аруначалам К., Гилл Х.С., Чандра РК. Повышение естественной иммунной функции за счет диетического потребления Bifidobacterium lactis (HN019). Eur J Clin Nutr 2000; 54: 263-7. Просмотр аннотации.
Бибилони Р., Федорак Р.Н., Таннок Г.В. и др. Пробиотическая смесь VSL # 3 вызывает ремиссию у пациентов с активным язвенным колитом. Am J Gastroenterol 2005; 100: 1539-46. Просмотр аннотации.
Bouhnik Y, Pochart P, Marteau P, et al. Восстановление фекалий у людей жизнеспособных бифидобактерий, попавших в ферментированное молоко. Гастроэнтерология 1992; 102: 875-8. Просмотр аннотации.
Чен Р.М., Ву Дж.Дж., Ли С.К. и др. Увеличение кишечных бифидобактерий и подавление бактерий группы кишечной палочки при кратковременном приеме йогурта. J Dairy Sci 1999: 82: 2308-14. Просмотр аннотации.
Chiang BL, Sheih YH, Wang LH, et al. Повышение иммунитета путем употребления с пищей пробиотических молочнокислых бактерий (Bifidobacterium lactis HN019): оптимизация и определение клеточных иммунных ответов.Eur J Clin Nutr 2000; 54: 849-55. Просмотр аннотации.
Colombel JF, Cortot A, Neut C, Romond C. Йогурт с Bifidobacterium longum снижает желудочно-кишечные эффекты, вызванные эритромицином. Ланцет 1987; 2: 43.
Кремонини Ф., Ди Каро С., Ковино М. и др. Влияние различных пробиотических препаратов на побочные эффекты, связанные с терапией против Helicobacter pylori: параллельное групповое, тройное слепое, плацебо-контролируемое исследование. Am J Gastroenterol 2002; 97: 2744-9. Просмотр аннотации.
Элмер GW, Суравич CM, МакФарланд LV.Биотерапевтические агенты, метод лечения и профилактики отдельных кишечных и вагинальных инфекций, которым пренебрегают. JAMA 1996; 275: 870-5. Просмотр аннотации.
Gionchetti P, Rizzello F, Venturi A, et al. Пероральная бактериотерапия в качестве поддерживающей терапии у пациентов с хроническим поучитом: двойное слепое плацебо-контролируемое исследование. Гастроэнтерология 2000; 119: 305-9. Просмотр аннотации.
Голдин BR. Польза пробиотиков для здоровья. Br J Nutr 1998; 80: S203-7. Просмотр аннотации.
Ha GY, Yang CH, Kim H, Chong Y.Случай сепсиса, вызванного Bifidobacterium longum. J. Clin Microbiol 1999; 37: 1227-8. Просмотр аннотации.
Хираяма К., Рафтер Дж. Роль пробиотических бактерий в профилактике рака. Microbes Infect 2000; 2: 681-6. Просмотр аннотации.
Hoyos AB. Снижение частоты возникновения некротического энтероколита, связанного с энтеральным введением Lactobacillus acidophilus и Bifidobacterium infantis новорожденным в отделении интенсивной терапии. Int J Infect Dis 1999; 3: 197-202. Просмотр аннотации.
Исикава Х., Акедо И., Умесаки Ю. и др.Рандомизированное контролируемое исследование влияния ферментированного бифидобактериями молока на язвенный колит. J Am Coll Nutr 2003; 22: 56-63. Просмотр аннотации.
Isolauri E, Arvola T, Sutas Y, et al. Пробиотики в лечении атопической экземы. Clin Exp Allergy 2000; 30: 1604-10. Просмотр аннотации.
Калима П., Мастертон Р.Г., Родди П.Х. и др. Инфекция Lactobacillus rhamnosus у ребенка после трансплантации костного мозга. J Infect 1996; 32: 165-7. Просмотр аннотации.
Като К., Мизуно С., Умесаки Ю. и др.Рандомизированное плацебо-контролируемое исследование по оценке влияния ферментированного бифидобактериями молока на активный язвенный колит. Алимент Фармакол Тер 2004; 20: 1133-41. Просмотр аннотации.
Kim HJ, Camilleri M, McKinzie S, et al. Рандомизированное контролируемое испытание пробиотика VSL # 3 в отношении кишечного транзита и симптомов синдрома раздраженного кишечника с преобладанием диареи. Алимент Фармакол Тер 2003; 17: 895-904. . Просмотр аннотации.
Корщунов В.М., Смеянов В.В., Ефимов Б.А. и др. Терапевтическое применение препарата устойчивых к антибиотикам бифидобактерий у мужчин, подвергшихся воздействию высоких доз гамма-излучения.J Med Microbiol 1996; 44: 70-4. Просмотр аннотации.
Кухбахер Т., Отт С.Дж., Хельвиг У. и др. Бактериальная и грибковая микробиота в связи с пробиотической терапией (VSL # 3) при поучите. Кишечник 2006; 55: 833-41. Просмотр аннотации.
Льюис С.Дж., Фридман АР. Обзорная статья: использование биотерапевтических средств в профилактике и лечении желудочно-кишечных заболеваний. Aliment Pharmacol Ther 1998; 12: 807-22. Просмотр аннотации.
Leyer GJ, Li S, Mubasher ME, et al. Воздействие пробиотиков на частоту и продолжительность симптомов простуды и гриппа у детей.Педиатрия 2009; 124: e172-e179. Просмотр аннотации.
Ливин В., Пайффер И., Худо С. и др. Штаммы Bifidobacterium из резидентной микрофлоры желудочно-кишечного тракта человека грудного возраста обладают антимикробной активностью. Gut 2000; 47: 646-52. Просмотр аннотации.
Macfarlane GT, Каммингс Дж. Х. Пробиотики и пребиотики: может ли регулирование активности кишечных бактерий принести пользу здоровью? BMJ 1999; 318: 999-1003. Просмотр аннотации.
McFarland LV. Мета-анализ пробиотиков для профилактики диареи, связанной с антибиотиками, и лечения болезни Clostridium difficile.Am J Gastroenterol 2006; 101: 812-22. Просмотр аннотации.
Мейдани С.Н., Ха В.К. Иммунологические эффекты йогурта. Am J Clin Nutr 2000; 71: 861-72. Просмотр аннотации.
Miele E, Pascarella F, Giannetti E. et al. Влияние пробиотического препарата (VSL # 3) на индукцию и поддержание ремиссии у детей с язвенным колитом. Am J Gastroenterol 2009; 104: 437-43. Просмотр аннотации.
Мимура Т., Риццелло Ф., Хельвиг У. и др. Терапия пробиотиками в высоких дозах (VSL # 3) один раз в день для поддержания ремиссии при рецидивирующем или рефрактерном поухите.Кишечник 2004; 53: 108-14. Просмотр аннотации.
О’Махони Л., Маккарти Дж., Келли П. и др. Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и взаимосвязь с профилями цитокинов. Гастроэнтерология 2005; 128: 541-51. Просмотр аннотации.
Phuapradit P, Varavithya W., Vathanophas K, et al. Снижение ротавирусной инфекции у детей, получающих смесь с бифидобактериями. J Med Assoc Thai 1999; 82: S43-S48. Просмотр аннотации.
Пирс А. Практическое руководство по натуральным лекарствам Американской фармацевтической ассоциации.Нью-Йорк: The Stonesong Press, 1999: 19.
Расталл РА. Бактерии в кишечнике: друзья и враги и как изменить баланс. J Nutr 2004; 134: 2022S-2026S. Просмотр аннотации.
Раутио М., Джусими-Сомер Н., Каума Н. и др. Абсцесс печени, вызванный штаммом Lactobacillus rhamnosus, неотличимым от штамма L. rhamnosus GG. Clin Infect Dis 1999; 28: 1159-60. Просмотр аннотации.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr 2000; 71: 1682S-7S.Просмотр аннотации.
Saavedra JM, et al. Кормление младенцев в больнице бифидобактериями бифидум и термофильным стрептококком для профилактики диареи и выделения ротавируса. Ланцет 1994; 344: 1046-9. Просмотр аннотации.
Сайранен, У., Пиирайнен, Л., Грастен, С., Томпури, Т., Матто, Дж., Саарела, М., и Корпела, Р. Влияние пробиотиков ферментированного молока и инулина на функции и микроэкологию кишечника. J Dairy Res 2007; 74 (3): 367-373. Просмотр аннотации.
Saxelin M, Chuang NH, Chassy B и др.Лактобациллы и бактериемия на юге Финляндии 1989-1992 гг. Clin Infect Dis 1996; 22: 564-6. Просмотр аннотации.
Scarpignato C, Rampal P. Профилактика и лечение диареи путешественников: клинический фармакологический подход. Химиотерапия 1995; 41: 48-81. Просмотр аннотации.
Салливан А, Баркхольт Л, Север СЕ. Lactobacillus acidophilus, Bifidobacterium lactis и Lactobacillus F19 предотвращают связанные с антибиотиками экологические нарушения Bacteroides fragilis в кишечнике. Журнал Antimicrob Chemother 2003; 52: 308-11.Просмотр аннотации.
Табберс М.М., Миллиано I, Роузбум М.Г., Беннинга М.А. Эффективны ли Bifidobacterium breve при лечении запоров у детей? Результаты пилотного исследования. Нутр Ж 2011; 10:19. Просмотр аннотации.
Tursi A, Brandimarte G, Giorgetti GM, et al. Низкие дозы бальсалазида в сочетании с сильнодействующим пробиотическим препаратом более эффективны, чем один бальсалазид или месалазин при лечении острого язвенного колита легкой и средней степени тяжести. Med Sci Monit 2004; 10: PI126-31. Просмотр аннотации.
Вентури А, Джиончетти П., Риццелло Ф. и др. Влияние нового пробиотического препарата на состав фекальной флоры: предварительные данные по поддерживающей терапии больных язвенным колитом. Aliment Pharmacol Ther 1999; 13: 1103-8. Просмотр аннотации.
Сяо Дж.З., Такахаши С., Одамаки Т. и др. Чувствительность к антибиотикам штаммов бифидобактерий, распространенных на японском рынке. Biosci Biotechnol Biochem. 2010; 74 (2): 336-42. Просмотр аннотации.
пробиотиков для собак — Американский клуб собаководов
Если вы когда-либо ели йогурт с живыми культурами, возможно, вы принимали пробиотик.Этот термин относится к полезным или «дружественным» кишечным микробам (бактериям и дрожжам). В желудочно-кишечной системе всех животных их миллиарды, и они помогают переваривать пищу, борются с потенциальными патогенами, вырабатывают питательные вещества и витамины и укрепляют иммунную систему. Само слово происходит от латинского слова «для» (про) и греческого «жизнь» (био). Пробиотики для собак — это инструмент питания, который следует учитывать для здоровья вашего лучшего друга.
Иногда полезные микробы повреждаются или уничтожаются, что может вызвать расстройство желудка и общее ухудшение здоровья.Если ваша собака страдает диареей или связанными с ней проблемами или кажется, что она болеет чаще, чем другие собаки без видимой причины, ваш ветеринар может предложить использовать один из методов для увеличения количества полезных бактерий:
- Пребиотики — это питательные вещества, предназначенные для питания и стимулирования роста полезных бактерий, которые уже живут в толстой кишке.
- Пробиотики, также называемые «микробами прямого кормления» органом по регулированию кормов для домашних животных AAFCO (Ассоциация американских чиновников по контролю кормов).
Эти продукты бывают разных форм, в том числе:
- Йогурт или кефир с живыми культурами. Имейте в виду, что не все йогуртовые культуры одинаковы. Некоторые культуры были использованы для производства продукта, но не являются пробиотиками. Предлагайте собаке только несладкий простой йогурт и внимательно читайте этикетки, чтобы избежать использования всех искусственных подсластителей.
- Порошки, например Purina ProPlan FortiFlora
- Капсулы
- Жует
- Корма для собак
Эти продукты обычно содержат виды бактерий, обычно встречающихся в кишечнике собак, например:
- Lactobacillus acidophilus
- Enterococcus faecium
- Bifidobacterium lactis
- Lactobacillus casei
- Bifidobacterium breve
Как покупать пробиотический продукт и ухаживать за ним
Гейл Чарнецки-Молден, Ph.Д., старший диетолог-исследователь компании Nestle Purina и один из разработчиков FortiFlora, говорит, что большая проблема этих продуктов в том, что они являются хрупкими живыми существами. «Когда вы смотрите на пробиотик, вы видите живые бактерии, которые были адаптированы к жизни в желудочно-кишечном тракте», — объясняет она в подкасте Canine Health Foundation. Воздействие воздуха, влаги или экстремальных температур повредит их жизнеспособности. Вот почему некоторые из этих продуктов продаются в отдельных порционных пакетах.Она также говорит, что люди должны помнить о температурных условиях при покупке пробиотических продуктов. «Вы не хотите покупать свои пробиотики, когда на улице 110 градусов, вы идете в торговый центр на четыре часа, а ваши пробиотики лежат в горячей машине пять или шесть часов. Маловероятно, что пробиотики выживут.
Кроме того, на этикетке упаковки с пробиотиками следует обратить внимание на несколько вещей, например:
- Список конкретных пробиотиков в продукте, включая идентификацию штамма.Доктор Чарнеки-Молден указывает на то, что существует несколько штаммов бактерий, и каждый делает что-то свое. Она цитирует исследование, в котором ученые изучали живые микробы — Lactobacillus acidophilus — выделенные из собачьих фекалий. Из 97 штаммов только 17 имели пробиотическую активность, но не все они были одинаковыми. Некоторые из них проявляли противовоспалительную активность, а другие были иммуностимуляторами. Она отмечает, что пробиотики не обязательно лучше использовать больше штаммов или различных форм бактерий, поскольку они могут работать друг против друга.По ее словам, из проведенных исследований эффективности пробиотиков большинство было проведено с отдельными штаммами.
- Гарантированный анализ количества живых бактерий в конце срока годности. Некоторые компании могут сказать, сколько живых бактерий содержится в продукте на момент его производства, но к моменту покупки продукта все пробиотики могут умереть.
- Срок годности.
Когда используются пробиотики?
Согласно Ветеринарному руководству Merck, пробиотикичаще всего назначают для поддержания «желаемого баланса кишечных микробов».
Когда животное находится в состоянии стресса или болеет, баланс между здоровыми и болезнетворными микробами может быть нарушен. Это может привести к диарее, газам, спазмам и неприятному запаху изо рта.Некоторые из факторов, вызывающих такие расстройства пищеварения, включают:
- Инфекция или бактериальный дисбаланс
- Стресс: Как и у людей, изменения, вызывающие эмоциональный стресс, такие как посадка, переезд или потеря дома, могут привести к колиту. Это одна из причин, почему многие собаки в приютах страдают диареей.Некоторые исследования показали, что пробиотики действуют так же, как и антибиотики, при устранении диареи у собак из приюта.
- Диета: это может включать резкие изменения в меню или употребление в пищу испорченной пищи, которая просто не подходит собаке.
- Старость
- Лекарства. Известно, что антибиотики и стероиды длительного приема вызывают диарею, убивая полезные бактерии.
- Паразиты
Вы можете подумать о том, чтобы дать своей здоровой собаке пробиотик, если она склонна к развитию диареи в стрессовых ситуациях.Например, если вы планируете взять собаку на выставку или сесть на нее, возможно, имеет смысл дать пробиотики на несколько дней вперед. Кроме того, щенкам, у которых часто бывает диарея после учебных занятий или посещений ветеринара, например, может быть полезно несколько дней приема пробиотиков при подготовке к стрессовому событию.
Работают ли пробиотики?
Неофициальные свидетельства — истории об индивидуальном успехе — существуют в поддержку эффективности пробиотиков, и некоторые ветеринары ими доверяют.Есть несколько научных исследований о пользе пробиотиков для здоровья человека и животных, а также об усилении иммунных реакций у растущих собак. Одно ирландское исследование 2009 года показало, что добавление определенного штамма Bifidobacterium animalis сокращает продолжительность диареи с семи до четырех дней. Это также устранило необходимость лечения антибиотиками примерно на 10 процентов по сравнению с плацебо.
AKC является участником партнерских рекламных программ, предназначенных для предоставления сайтам средств для получения рекламных сборов за счет рекламы и ссылок на akc.орг. Если вы покупаете продукт по этой статье, мы можем получить часть от продажи.
границ | Модуляция бифидобактериальных сообществ микробиоты собак цеолитом
Введение
Популяция домашних животных в западных странах увеличивается, и собаки являются основными спутниками людей. Взаимный интерес превратился в животных-компаньонов, которые стали неотъемлемой частью человеческой жизни, и поэтому здоровье и благополучие домашних животных вызывают все больший интерес в последние десятилетия.На протяжении истории рацион собак менялся, начиная с хищного поведения и диеты с высоким содержанием белка (Clauss et al., 2010) до богатой углеводами диеты и городского образа жизни.
Несмотря на долгую историю совместной эволюции человека и собаки, сведения о составе кишечной микробиоты собак гораздо менее полны, чем у людей. Желудочно-кишечный тракт (ЖКТ) собаки представляет собой богатую экосистему, состоящую из широкого спектра метаболически активных микроорганизмов (Simpson et al., 2002; Suchodolski et al., 2008; Kerr et al., 2013a). Преобладающие бактериальные филы в толстой кишке и кале собак представлены Firmicutes (40–60%), Bacteroidetes (5–10%), Proteobacteria (15–20%) и Fusobacteria (5 %) (Kerr et al., 2013b; Deng and Swanson, 2015), что составляет примерно 99% кишечной микробиоты собак. Однако очень мало известно о появлении в кишечнике стимулирующих здоровье микроорганизмов, таких как бифидобактерии, особенно при использовании подходов, основанных на метагеномике (Gavini et al., 2006; Jia et al., 2010).
Бифидобактерии — это грамположительные бактерии, которые колонизируют различные экологические ниши, но представляют собой одного из основных колонизаторов млекопитающих на самых ранних этапах жизни (Milani et al., 2015). Анализ микробиоты кишечника различных млекопитающих показывает, что некоторые виды бифидобактерий, обычно обнаруживаемые в ЖКТ человека, также были идентифицированы у многих других животных (Lamendella et al., 2008). Например, Bifidobacterium bifidum, B. adolescentis, B.catenulatum и B. dentium — бифидобактерии человеческого типа (Duranti et al., 2015, 2016), но эти таксоны продемонстрировали космополитическое экологическое поведение среди различных млекопитающих (Lamendella et al., 2008).
У охотничьих собак эмоциональный стресс, которому они подвергаются во время дрессировки, может изменить среду обитания желудочно-кишечного тракта (Rutgers et al., 1996). Следовательно, поддержание подходящей функции ЖКТ с помощью соответствующих стратегий кормления представляет интерес, чтобы избежать колонизации кишечника энтеропатогенами (например,g., Escherichia coli, Salmonella ssp., Clostridium perfringens, C. difficile ) (McKenzie et al., 2010; Kerr et al., 2013a).
Чтобы избежать лечения антибиотиками, исследуются альтернативные продукты. Цеолититы — это алюмосиликаты, характеризующиеся открытой структурой, которая может вмещать самые разные ионы. Размер частиц, размер кристаллитов и степень агрегации цеолитного материала, а также пористость отдельных частиц определяют доступ поглощаемых жидкостей к цеолитной поверхности во время прохождения через ЖКТ и сильно влияют на его ионный обмен. адсорбционные и каталитические свойства (Papaioannou et al., 2005). Механизм действия цеолита, вероятно, будет многофункциональным. Были отмечены различные свойства цеолита в рационе животных, способствующие укреплению здоровья и продуктивности. К ним относятся эффект связывания аммиака, элиминация фекалиями p -крезола, замедляющее действие на транзит пищеварительного тракта, усиление активности панкреатических эзимов и эффект секвестрации афлатоксина (Papaioannou et al., 2005). Более того, недавно сообщалось о применении цеолита для снижения количества патогенов у цыплят-бройлеров (Prasai et al., 2016). Среди цеолититов хабазитовый цеолит (CZ) обладает высокой катионообменной емкостью и насыпной плотностью (Pabalan and Bertetti, 2001). Включение цеолитов в рацион было эффективным для животных (например, свиней, телят) и людей, страдающих желудочно-кишечными расстройствами (RodriguezFuentes et al., 1997; Papaioannou et al., 2005). На сегодняшний день нет данных об оценке воздействия цеолитов на микробиоту кишечника собак. Целью настоящего исследования было оценить влияние пищевых добавок CZ на фекальную микробиоту с особым акцентом на популяции бифидобактерий при обучении охотничьих собак с помощью культурально-зависимых методов и подхода микробного профилирования 16S рРНК / ITS (внутренний транскрибированный спейсер).
Материалы и методы
Заявление об этике
Это исследование было проведено в соответствии с рекомендациями этического комитета Пармского университета. Протокол был одобрен «Комитато ди Этика Università degli Studi di Parma», Италия. Все процедуры с животными выполнялись в соответствии с национальными руководящими принципами (Decretolegaltivo 26/2014) по защите животных, используемых в научных целях.
Животные и экспериментальная процедура
Двадцать взрослых собак английского сеттера, выращенных в одном питомнике, были отобраны как однородные по возрасту (средний возраст ± стандартное отклонение: 3.50 ± 1,9 года), масса тела (средний вес ± стандартное отклонение: 18,83 ± 2,96 кг) и пол (10 мужчин, 10 небеременных женщин). В зависимости от возраста, веса и пола животные были поровну разделены на две группы (группа из 10 собак -1 ), каждая из которых содержала отдельную зону отдыха внутри (2,70 м × 1,40 м) и загон снаружи (4,50 м × 1,40 м). . У животных не было никаких клинических симптомов, указывающих на желудочно-кишечные заболевания, и они не получали лекарств, которые, как ожидается, изменяют микробиоту кишечника, таких как антибиотики.За месяц до начала исследования собак выкармливали. Характеристики групп представлены в таблице 1. В течение 28 дней обе группы получали диету на основе сырого мяса птицы (25% сырого протеина, 24% эфирного экстракта, 5% золы, 2% сырой клетчатки и 18,4 МДж кг (-1 ME, по сухому веществу). Индивидуальный рацион, вводимый из расчета примерно 25 г сухого вещества кг -1 массы тела 0,75 , один раз в день, был дополнен (группа Tr) или нет (группа NTr) порошком CZ в дозе 5 г в день -1 .Для каждой собаки цеолит взвешивали и добавляли в рацион при каждом приеме пищи. Был обеспечен свободный доступ к воде. В ходе исследования все собаки ежедневно подвергались аэробной физической активности, характеризовавшейся галопом в течение 20 минут, в соответствии с практикой тренера. Тренировки проводились на двух соседних площадках на открытом воздухе при средней температуре и относительной влажности 24 ± 3 ° C и 67 ± 10% соответственно. Внутри каждой группы было идентифицировано пять пар собак, и каждая из них была поочередно назначена на одну или другую тренировочную площадку.
ТАБЛИЦА 1. Характеристики экспериментальных групп (среднее ± стандартное отклонение).
Источник хабазитового цеолита
Порошок CZ получали после стерилизации при 200 ° C в течение 20 мин (Chabasite 70 ® Verdi S.p.A, Италия). Общее содержание цеолита составляло 70 ± 5%, из которых 65 ± 3% за счет шабазита (Na0,14K1,03Ca1,00Mg0,17) [Al3,46Si8,53O24] × 9,7H 2 O и 5 ± 3% до филлипсит (Na0.9Ca0.5K0.6) [Si5.2A12.8O16] × 6H 2 O.Следы клиноптилолита не обнаружены. Состав цеолитного порошка определяли методом Rietveld-RIR (Gualtieri, 2000). Катионообменная емкость и насыпная плотность в зависимости от размера частиц составляли 2,2 ± 0,1 мэкв. Г -1 и 0,70-0,90 г (см 3 ) -1 , соответственно (Gualtieri, 2000; Cresswell and Hamilton, 2002 ). Удержание воды по отношению к размеру частиц составляло примерно 30-40% (мас. / Мас.). Гранулометрия порошка была менее 100 мкм.
Сбор образцов кала
Консистенцию фекалий оценивали по шкале от 1 (твердый) до 5 (водянистый) (Grieshop et al., 2002) в дни 0 (момент времени 0, T0), 16 (момент времени 1, T1) от начала диетического лечения и в конце экспериментального периода (день 29, момент времени 2, T2). В те же дни отдельные образцы фекалий собирали непосредственно из прямой кишки с использованием стерильной перчатки, смазанной водой. Кал помещали в стерильные полиэтиленовые пакеты, сразу же транспортировали в лабораторию на пакетах со льдом и замораживали при -20 ° C до анализа.
16S рРНК / ITS микробный профиль
По прибытии в лабораторию отдельные образцы фекалий были разделены на аликвоты и объединены с другими отдельными образцами, полученными при той же обработке, для формирования объединенных образцов.Фактически, в области здоровья животных недавно было показано, что объединение образцов стула позволяет быстро оценить интенсивность инфекции и эффективность лекарств (Mekonnen et al., 2013). Каждая индивидуальная выборка собак была одинаково представлена в соответствующей объединенной выборке. ДНК экстрагировали из объединенных образцов фекалий с использованием набора QIAamp DNA Stool Mini, следуя инструкциям производителя (Qiagen Ltd., Strasse, Германия).
Частичные последовательности гена 16S рРНК амплифицировали из экстрагированной ДНК с использованием пары праймеров Probio_Uni и / Probio_Rev, которые нацелены на область V3 последовательности гена 16S рРНК, как сообщалось ранее (Milani et al., 2013). Частичные последовательности ITS амплифицировали из экстрагированной ДНК с использованием пары праймеров Probio-bif_Uni / Probiobif_Rev, как описано Milani et al. (2014b). Используемые условия ПЦР: 5 минут при 95 ° C и 35 циклов по 30 секунд при 94 ° C, 30 секунд при 55 ° C и 90 секунд при 72 ° C, а затем 10 минут при 72 ° C. Амплификацию проводили с использованием термоциклера Veriti (Applied Bio-systems).
гена 16S рРНК и ITS-секвенирование выполняли с использованием MiSeq (Illumina) в соответствии с ранее опубликованными протоколами (Milani et al., 2013, 2014б).
Анализ микробиоты на основе генов 16S рРНК
Достигнутые считывания отдельных последовательностей были отфильтрованы программным обеспечением Illumina для удаления низкокачественных и поликлональных последовательностей. Все данные, одобренные компанией Illumina по качеству, обрезанные и отфильтрованные, были экспортированы в виде файлов .fastq. Файлы.fastq обрабатывались с использованием специального сценария на основе программного пакета QIIME (Caporaso et al., 2010). Пары чтения с парным концом были собраны для реконструкции полных ампликонов Probio_Uni / Probio_Rev.Контроль качества сохранил последовательности длиной от 140 до 400 п.н. и среднюю оценку качества последовательности> 20, в то время как последовательности с гомополимерами> 7 п.н. и несовпадающими праймерами были опущены. Для расчета последующих показателей разнообразия (индексы альфа-разнообразия, анализ Unifrac) операционные таксономические единицы (OTU) 16S рРНК были определены с гомологией последовательностей ≥97% с использованием uclust (Edgar, 2010), а OTU с менее чем 10 последовательностями были отфильтрованы. Все чтения были отнесены к самому низкому таксономическому рангу с использованием QIIME (Caporaso et al., 2010) и набор справочных данных из базы данных SILVA (Quast et al., 2013). Биоразнообразие образцов (альфа-разнообразие) рассчитывалось с помощью индекса Chao1.
Анализ микробиоты на основе ITS
Для анализа микробиоты на основе ITS Файлы Fastq, полученные путем секвенирования ампликонов ITS, были проанализированы с использованием специального сценария, названного сценарием bif_ITS_analysis.sh. Этот сценарий требует, чтобы QIIME (Caporaso et al., 2010) был установлен (или работает на виртуальной машине QIIME) и принимает .bam или.Входные файлы fastq, содержащие последовательное чтение. Входные данные обрабатывались, как описано ранее (Milani et al., 2014b).
Количество бактерий
Гомогенатные образцы фекалий серийно разбавляли анаэробным бульоном Уилкинса-Чалгрена половинной концентрации (WCAB) и забуференной пептонной водой (ThermoScientific-Oxoid, Великобритания). Разведения в двух экземплярах высевали на агар MacConkey (Merck, Германия) для Enterobacteriaceae, агар Perfringens Base (OPSP) (Oxoid, UK) для C. perfringens , агар с ванкомицином и бромкрезоловым зеленым (LAMVAB) (Hartemink and Rombouts, 1999) для lactobacilli и азид-мальтозный агар (Biolife, Италия) для подсчета энтерококков.Планшеты с агаром MacConkey и азидомальтозным агаром инкубировали в аэробных условиях при 37 ° C в течение 24 и 48 часов соответственно. Остальные среды инкубировали в анаэробных условиях при 37 ° C в течение 48-72 часов. Таксономию колоний, случайно выделенных на селективных средах, определяли на уровне родов и видов с помощью API System (Bio-Merieux, Италия) для проверки надежности используемых сред.
In vitro CZ Адсорбционная способностьСпособность CZ связываться с энтеропатогенными бактериями оценивали в объединенных фекалиях с использованием двух эталонных штаммов, т.е.е., E. coli ATCC 35218 и C. perfringens ATCC 13124. Штаммы выращивали в бульоне Мюллера-Хинтона (Дифко, Мичиган, США) при 37 ° C в течение 24 часов, затем переносили в 10 мл бульона и выращивали еще 8 ч для достижения финальной экспоненциальной фазы.
Адсорбционная способность CZ была оценена путем спектрофотометрического измерения OD образцов (An and Friedman, 1997). Двадцать пять граммов объединенных фекалий, полученных группами NTr и собранных в дни 0, 16 и 29, помещали в трех экземплярах в колбы, содержащие 225 мл забуференного раствора хлорида натрия-пептона с pH 7.0 (Oxoid, Великобритания). CZ добавляли в разных количествах (0, 0,25, 0,5, 1 г). Наконец, в среду добавляли штаммы C. perfringens ATCC 13124 или E. coli ATCC 35218 и инкубировали при 37 ° C. Через 0, 2, 4, 6 и 24 часа 150 мкл суспензии переносили в микротитровальный планшет в четырех повторностях, и сразу же оценивали оптическую плотность (VICTOR3, многопозиционный счетчик 1420, PerkinElmer, Италия) при 620 нм.
Статистический анализ
Данные по количеству фекалий и количеству фекальных бактерий были проверены на нормальность, а затем проанализированы с помощью ANOVA с использованием процедуры GLM в SAS (версия 9.4, SAS Institute Inc., США). Смешанная модель включала фиксированные эффекты группы (два уровня), времени выборки (три уровня), взаимодействие между группой и временем выборки и случайный эффект животного. Значения колониеобразующих единиц (КОЕ) были выражены как log 10 г -1 фекалий.
Статистическая значимость была достигнута для P ≤ 0,05, поскольку значение P > 0,05 и ≤0,10 рассматривалось как тренд.
Размещение данных
Необработанные последовательности профилей гена 16S рРНК доступны через регистрационный номер исследования SRA SRP075756.Необработанные последовательности ITS-профилирования доступны через регистрационный номер исследования SRA SRP080281.
Результаты
Профилирование 16S рРНК собаки, обработанной CZ
Объединенные образцы фекалий собак, получавших CZ (Tr) и не получавших лечения (NTr), были получены для оценки состава микробиоты на основе анализа секвенирования 16S рРНК, как описано ранее (Milani et al., 2013). В результате секвенирования было получено в общей сложности 589784 считывания, в среднем 98297 считываний на образец (дополнительная таблица S1).
Оценка кривых разрежения, основанная на индексах биоразнообразия Chao1, рассчитанных для 10 подвыборок из секвенированных пулов считывания, показала, что обе кривые имеют тенденцию выходить на плато. Таким образом, во всех случаях полученные данные секвенирования были сочтены достаточными для охвата подавляющего большинства биоразнообразия, содержащегося в образцах (рис. 1A). Более того, две кривые не показали значимых различий, что указывает на то, что проанализированные образцы имеют одинаковое биоразнообразие.
РИСУНОК 1. Изучение таксономического профиля групп NTr и Tr. (A) Показывает кривые разрежения, представляющие изменение индексов разнообразия Chao1 и Шеннона при увеличении глубины секвенирования образцов фекалий NTr и Tr. (B) Отображает гистограммы и тепловую карту идентифицированных бактериальных типов в объединенных образцах, обработанных или необработанных CZ. (C) Представляет гистограммы и тепловую карту идентифицированных родов бактерий в объединенных образцах Tr или NTr. (D) демонстрирует изменение таксонов в момент времени T1 (вверх) и T2 (внизу).Мы сообщили о бактериальных родах с процентным абсолютным изменением> 0,05% и показав увеличение> 100% или уменьшение <-50% процента относительного изменения в наборах данных Tr по сравнению с данными, полученными из образцов NTr. На всех панелях термин «неклассифицированный член» сокращен до U. m ..
Состав кишечной микробиоты собак, обработанных CZ
Во время исследования случаев диареи у собак, получавших CZ, не наблюдалось. CZ не влиял на вкусовые качества корма, который был полностью съеден в течение 30 минут после дозирования.На показатели кала не влияли факторы статистической модели ( P > 0,05; Таблица 2). Различия фекальной микробиоты наблюдались в зависимости от группы и времени отбора проб ( P <0,05).
ТАБЛИЦА 2. Влияние добавок шабазитового цеолита (CZ) на счет в фекалиях и концентрацию микробов в фекалиях (среднее значение логарифма наименьших квадратов 10 КОЕ г -1 фекалий).
Проверка предсказанных таксономических профилей на уровне филума для всех образцов NTr (T0, NTrT1, NTrT2) показала, что Firmicutes (в среднем 51.15% ± 11,46%) представляли доминирующий тип сообщества слепой кишки у собак, превосходя по численности Proteobacteria (в среднем 27,06 ± 15,75%), Fusobacteria (в среднем 8,54 ± 3,46%) и Bacteroidetes (среднее 5,49% ± 2,62%) филы (рисунки 1В, В).
Сравнение средней относительной численности образцов NTr и Tr в момент времени T1 выявило уменьшение количества членов семейства Enterobacteriaceae (-66,99%), таких как Escherichia (-67.16%), Klebsiella (-94,75%) и Hafnia (-74,87%) в образцах Tr (Рисунок 1D) и увеличение на Lactobacillus (205,16%) и Bifidobacterium (75,35%) в Животные, обработанные CZ (рис. 1D). В момент времени T2 у животных, получавших CZ (рис. 1D), уменьшение Enterobacteriaceae (-15,34%) включает уменьшение родов Hafnia (-67,85%), Klebsiella (-77,18%) и Enterobacter (-84,69%), наряду с увеличением относительной численности Lactobacillus (861.64%) и Bifidobacterium (157,73%) (рис. 1D).
Примечательно, что данные, полученные с помощью культурально-зависимых подходов, в значительной степени подтвердили результаты, полученные с помощью микробного профилирования 16S рРНК. Фактически, Lactobacillus ssp. и Enterococcus ssp. количество было выше, в то время как количество энтеробактерий и было ниже в группе Tr, чем в группе NTr ( P <0,05). Lactobacillus ssp. количество, как правило, было выше в группе Tr, чем в группе NTr на 16-й день (T1; 7.43 против 7,24; P <0,10) и были выше на 29 день (T2; 8,18 против 7,25; P <0,05). Увеличение Enterococcus ssp. Концентрация (8,10 против 7,27) и уменьшение количества энтеробактерий на (6,24 против 7,14) были обнаружены в группе Tr по сравнению с группой NTr на 29 день (T2; P <0,05). Кроме того, не было зарегистрировано никаких изменений в количестве C. perfringens в фекалиях в зависимости от времени отбора проб и лечения ( P > 0.05).
Модуляция сообщества бифидобактерий с помощью CZ
Сосредоточив внимание на вкладе бифидобактерий в общую микробиоту собак, стоит отметить, что в день 0 (T0) и у животных NTr на дни 16 и 29 (T1 и T2, соответственно) этот род составляет 2,32% ± 1,88% от общего количества животных. микробиота кишечника охотничьих собак. У обработанных животных (Tr) присутствие рода Bifidobacterium показало увеличение примерно на 157,73% по сравнению с животными Tr в момент T2 после 29 дней диеты CZ (рис. 1D).
Чтобы точно каталогизировать влияние на популяцию бифидобактерий собак после лечения CZ, мы выполнили ITS-профилирование сообществ бифидобактерий в образцах стула собак Tr и NTr.
Качественная фильтрация секвенированных ITS-ампликонов дала в среднем 52468 высококачественных и полноразмерных считываний на образец (дополнительная таблица S2), которые были таксономически отнесены к минимальному таксономическому рангу вида.
Состав бифидобактериальных популяций собак, включенных в анализ, показал наличие специфических видов, таких как B.pseudolongum (в среднем 60,70% ± 24,61% для образцов T0 и NTr) и B. animalis (в среднем 7,84% ± 7,50% у собак T0 и NTr) (рис. 2A), которые ранее были описаны как типичные для ЖКТ животных (Milani et al., 2014a) и особенно ЖКТ собаки (Gavini et al., 2006). Примечательно, что другие виды бифидобактерий, ранее описанные как типичные для кишечника человека, такие как B. catenulatum и B. bifidum , были обнаружены в более низкой степени (рис. 2B).
РИСУНОК 2. Исследование популяции бифидобактерий NTr и Tr групп. (A) представляет гистограммы идентифицированных бифидобактерий в объединенных образцах, обработанных или необработанных CZ, посредством анализа ITS. (B) Показывает тепловую карту идентифицированных бифидобактерий в объединенных образцах Tr-ITS или NTr-ITS. (C) Отображает изменение популяции бифидобактерий в момент времени T1 (вверх) и T2 (внизу). Мы сообщили о виде Bifidobacterium с абсолютным процентным изменением> 0.05% и демонстрирует увеличение> 100% или уменьшение <-50% процента относительного изменения в наборах данных Tr-ITS по сравнению с данными, полученными из образцов NTr-ITS. На всех панелях термин «неклассифицированный член» сокращен до U. m ..
Кроме того, в необработанных образцах животных (NTr1 и NTr2) ITS-анализ выявил наличие видов B. longum, B. gallinarum и B. pseudocatenulatum , типичных таксонов бифидобактерий человека (Milani et al., 2014a). Одним из возможных объяснений присутствия этих видов в микробиоте кишечника собак может быть передача бактерий между животными и дрессировщиками, о чем ранее сообщалось в литературе (Song et al., 2013). Однако потребуются дальнейшие исследования. Примечательно, что большая часть OTU, определенных как «неклассифицированные» в образцах T0 собак (Рисунки 2A, B), кластеры отдельно от любого известного в настоящее время таксона бифидобактерий, таким образом предположительно представляя новые таксоны Bifidobacterium . Эти предполагаемые новые неклассифицированные виды бифидобактерий представляют второй наиболее часто встречающийся таксон бифидобактерий в микробиоте собак как у Tr, так и у NTr животных (Рисунки 2A, B).
Как сообщалось выше, в момент времени T2 у животных, получавших CZ, наблюдалось увеличение относительной численности рода Bifidobacterium (рис. 1D).Эксперименты по профилированию ITS выявили увеличение на 803,14 и 54,76% для видов B. animalis и видов B. pseudolongum , соответственно, после добавления CZ. Более того, небольшое увеличение было обнаружено также для идентифицированных здесь предполагаемых новых таксонов бифидобактерий в TrT2 (12,45%) по сравнению с NTrT2 (Рисунок 2C).
In vitro Тест на бактериальную адсорбциюCZ показал адсорбционную способность по отношению к E. coli, (рис. 3A) и C.perfringens (рис. 3В) в исследовании, зависящем от дозы и времени. Различия между уровнями CZ были зарегистрированы для обоих штаммов через 2, 4, 6 и 24 ч инкубации ( P <0,05). В частности, более высокая адсорбционная способность против штамма E. coli наблюдалась при добавлении CZ в среду в дозах 0,5 и 1 г, а не 0 и 0,25 г ( P <0,05). При добавлении CZ в дозе 1 г отрицательные значения OD, начиная с 0 ч инкубации, наблюдались для E.coli . В течение первых шести часов инкубации адсорбционный эффект CZ на штамме C. perfringens был выше для уровней 0,5 и 1 г, чем для 0 и 0,25 г ( P <0,05; Рисунок 3).
РИСУНОК 3. In vitro адсорбционная способность шабазитового цеолита (CZ) по отношению к Escherichia coli (A) и Clostridium perfring2 () . Уровни CZ: (▪) 0 г, (▲) 0.25 г, (◆) 0,5 г, (●) 1 г. Планки погрешностей указывают на стандартные ошибки; a, b, c, d, P <0,05 (различия между уровнями CZ).
Обсуждение
У охотничьих собак эмоциональные факторы, такие как те, которым они подвергаются во время дрессировки, могут влиять на проницаемость, подвижность, секрецию и выработку муцина ЖКТ. Таким образом, в конечном итоге изменяются среда обитания резидентных кишечных бактерий и стимулируются изменения в составе кишечной микробиоты (Gagne et al., 2013). Поэтому были разработаны различные стратегии кормления, чтобы поддерживать подходящую функцию желудочно-кишечного тракта.Цеолит и, в частности, CZ показали эффективность у животных (например, свиней, телят) и людей, страдающих желудочно-кишечными расстройствами (RodriguezFuentes et al., 1997; Papaioannou et al., 2005).
В этом исследовании 20 взрослых собак английского сеттера были обучены и скармливались диетой, дополненной CZ, чтобы оценить, как можно регулировать микробиоту и, в частности, популяцию бифидобактерий, а также конкретные кишечные патогены.
Результаты, полученные после 29 дней диеты CZ, показали, что CZ влияет на концентрацию микробов в кале, но не на оценку в кале, которая остается в желаемом диапазоне (хорошо сформированный мягкий стул) для здоровых собак (Gagne et al., 2013). Примечательно, что мы наблюдали увеличение относительной численности Lactobacillus ssp. а также Bifidobacterium ssp. филотипов, сопровождающееся уменьшением филотипов, принадлежащих к семейству Enterobacteriaceae , в образцах фекалий CZ. Это может быть подтверждено адсорбционной способностью, используемой CZ в отношении E. coli и C. perfringens . Кроме того, E. coli и Enterobacter являются частыми причинами внекишечных оппортунистических инфекций у собак (Ogeer-Gyles et al., 2006), а C. perfringens тесно связан с геморрагическим гастроэнтеритом (Schlegel et al., 2012).
Более того, большое присутствие лактобацилл и бифидобактерий может быть очень интересным, поскольку считается, что эти бактериальные таксоны играют полезную роль в здоровье своих хозяев (Gibson et al., 2005). В этом контексте различные представители видов Lactobacillus и Bifidobacterium являются наиболее часто используемыми пробиотическими бактериями, используемыми для домашних животных (Kelley et al., 2010; Strompfova et al., 2014), и некоторые из них были предложены для улучшения здоровья и функции мозга собак (Biagi et al., 2007; Bravo et al., 2011). Повышенные концентрации этих микроорганизмов были связаны со снижением концентраций потенциально патогенных бактерий в кале и снижением уровней канцерогенных и гнилостных соединений в пищеварительном тракте (Grieshop et al., 2002).
Это первое исследование, в котором бифидобактериальное сообщество здоровой собаки было изучено с помощью подхода секвенирования нового поколения, включающего ITS-профилирование бифидобактерий.Полученные результаты позволили идентифицировать профиль бифидобактерий у охотничьих собак английского сеттера и выявили присутствие типичных бифидобактерий животных, таких как B. animalis и B. pseudolongum , а также многих предполагаемых новых таксонов. Обработка CZ привела к увеличению численности видов B. animalis и B. pseudolongum , которые характеризуются наличием генов, кодирующих структуры экзополисахаридов, которые могут привести к особой защите клеток (Ferrario et al., 2016; Идальго-Кантабрана и др., 2016). Увеличение штаммов бифидобактерий в сочетании с адсорбционной способностью CZ может привести к сокращению видов, принадлежащих к семейству Enterobacteriaceae , таких как Klebsiella и Enterobacter , типичных патогенов собак (Gibson et al., 2008). Комбинированное лечение CZ с добавкой пробиотиков, таких как штаммы бифидобактерий, может способствовать сокращению количества патогенов у собак, а также усилить благотворное влияние на здоровье животных.
Заключение
Диетическая добавка CZ может помочь поддерживать сбалансированную микробную экосистему кишечника и предотвратить связанные со стрессом расстройства ЖКТ у здоровых собак с уменьшением количества патогенов кишечника и значительным увеличением количества бифидобактерий. Это особенно актуально при дрессировке охотничьих собак, где умственное и физическое напряжение, которому они подвергаются во время тренировок, может повлиять на проницаемость и подвижность желудочно-кишечного тракта. Необходимы дальнейшие исследования, чтобы подтвердить положительный эффект CZ также на больных собак.
Авторские взносы
АС, ПС, ВБ и МО спроектировали и провели эксперименты. Рукопись написали MO, LM, AS, PS и CF. LM и CM выполнили биоинформатический анализ. AS, CF, PS, MO и VB проводили эксперименты. CM, LM, ER и FDI прокомментировали рукопись. PS, AS и MO разработали исследование, отредактировали и одобрили рукопись. Все авторы рецензировали рукопись.
Финансирование
LM поддерживается Фондом Карипарма, Парма, Италия.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Рецензент FB и управляющий редактор заявили о своей общей принадлежности, а управляющий редактор заявляет, что процесс, тем не менее, соответствовал стандартам справедливой и объективной проверки.
Благодарности
Авторы выражают искреннюю благодарность Verdi SpA, Италия за щедрое предоставление продукта Chabasite 70 ® , питомнику Della Bassana, Пегоньяга (Миннесота), Италия за предоставление необходимых помещений и собак и г-же Мирелле Масини за ее оперативный вклад в настоящее исследование. .
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/article/10.3389/fmicb.2016.01491
Сноски
- http://probiogenomics.unipr.it/sw/bif_ITS_analysis.zip
Список литературы
Ан, Ю. Х., и Фридман, Р. Дж. (1997). Лабораторные методы исследования бактериальной адгезии. J. Microbiol. Методы 30, 141–152. DOI: 10.1016 / S0167-7012 (97) 00058-4
CrossRef Полный текст | Google Scholar
Бьяджи, Г., Чиполлини, И., Помпеи, А., Загини, Г., и Маттеуцци, Д. (2007). Влияние штамма Lactobacillus animalis на состав и метаболизм микрофлоры кишечника взрослых собак. Вет. Microbiol. 124, 160–165. DOI: 10.1016 / j.vetmic.2007.03.013
CrossRef Полный текст | Google Scholar
Браво, Дж. А., Форсайт, П., Чу, М. В., Эскараваж, Э., Савиньяк, Х. М., Динан, Т. Г. и др. (2011). Проглатывание штамма Lactobacillus регулирует эмоциональное поведение и экспрессию центрального рецептора ГАМК у мыши через блуждающий нерв. Proc. Natl. Акад. Sci. США 108, 16050–16055. DOI: 10.1073 / pnas.1102999108
CrossRef Полный текст | Google Scholar
Caporaso, J. G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F. D., Costello, E. K., et al. (2010). QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Nat. Методы 7, 335–336. DOI: 10.1038 / nmeth.f.303
CrossRef Полный текст | Google Scholar
Клаусс, М., Клеффнер, Х., Кинцле, Э.(2010). Плотоядные млекопитающие: усвояемость питательных веществ и оценка энергии. Zoo Biol. 29, 687–704. DOI: 10.1002 / zoo.20302
CrossRef Полный текст | Google Scholar
Крессвелл, Х. П., и Гамильтон, Г. Дж. (2002). «Анализ размера частиц», в Soil Physical Measurement and Interpretation for Land Evaluation , eds N. J. McKenzie, H. P. Cresswell, and K. J. Coughlan (Collingwood, VIC: CSIRO Publishing), 224–239.
Google Scholar
Дэн, П., и Суонсон, К.С. (2015). Микробиота кишечника людей, собак и кошек: текущие знания и будущие возможности и проблемы. Br. J. Nutr. 113, S6 – S17. DOI: 10.1017 / S0007114514002943
CrossRef Полный текст | Google Scholar
Duranti, S., Milani, C., Lugli, G.A., Mancabelli, L., Turroni, F., Ferrario, C., et al. (2016). Оценка генетического разнообразия среди штаммов комменсала кишечника человека Bifidobacterium adolescentis . Sci. Реп. 6, 23971.DOI: 10.1038 / srep23971
CrossRef Полный текст | Google Scholar
Duranti, S., Milani, C., Lugli, G.A., Turroni, F., Mancabelli, L., Sanchez, B., et al. (2015). Информация о геномах представителей комменсала кишечника человека Bifidobacterium bifidum . Environ. Microbiol. 17, 2515–2531. DOI: 10.1111 / 1462-2920.12743
CrossRef Полный текст | Google Scholar
Эдгар Р. К. (2010). Поиск и кластеризация на порядки быстрее, чем BLAST. Биоинформатика 26, 2460–2461. DOI: 10.1093 / биоинформатика / btq461
CrossRef Полный текст | Google Scholar
Феррарио, К., Милани, К., Манкабелли, Л., Лугли, Г. А., Дуранти, С., Мангифеста, М., и др. (2016). Модуляция транскрипции эпс-ома бифидобактерий посредством моделирования кишечной среды человека. FEMS Microbiol. Ecol. 92, fiw056. DOI: 10.1093 / фемсек / fiw056
CrossRef Полный текст | Google Scholar
Gagne, J.W., Wakshlag, J. J., Simpson, K. W., Dowd, S. E., Latchman, S., Brown, D. A., et al. (2013). Влияние синбиотика на качество фекалий, концентрацию короткоцепочечных жирных кислот и микробиом здоровых ездовых собак. BMC Vet. Res. 9: 246. DOI: 10.1186 / 1746-6148-9-246
CrossRef Полный текст | Google Scholar
Gavini, F., Delcenserie, V., Kopeinig, K., Pollinger, S., Beerens, H., Bonaparte, C., et al. (2006). Bifidobacterium видов, выделенных из фекалий животных, а также из говядины и свинины. J. Food Prot. 69, 871–877.
Google Scholar
Гибсон, Г. Р., Маккартни, А. Л., и Расталл, Р. А. (2005). Пребиотики и устойчивость к желудочно-кишечным инфекциям. Br. J. Nutr. 93, S31 – S34. DOI: 10.1079 / Bjn20041343
CrossRef Полный текст | Google Scholar
Гибсон, Дж. С., Мортон, Дж. М., Кобболд, Р. Н., Сиджабат, Х. Э., Филиппич, Л. Дж., И Тротт, Д. Дж. (2008). Множественная лекарственная устойчивость E. coli и энтеробактерная внекишечная инфекция у 37 собак. J. Vet. Междунар. Med. 22, 844–850. DOI: 10.1111 / j.1939-1676.2008.00124.x
CrossRef Полный текст | Google Scholar
Гришоп, К. М., Фликингер, Э. А., и Фэи, Г. С. Младший (2002). Пероральный прием арабиногалактана влияет на иммунный статус и популяции фекальных микробов у собак. J. Nutr. 132, 478–482.
Google Scholar
Гуальтьери, А. Ф. (2000). Точность XRPD QPA с использованием комбинированного метода Ритвельда-RIR. J. Appl.Кристаллогр. 33, 267–278. DOI: 10.1107 / S002188989
3x
CrossRef Полный текст | Google Scholar
Хартеминк Р. и Ромбоут Ф. М. (1999). Сравнение сред для обнаружения бифидобактерий, лактобацилл и общих анаэробов в образцах фекалий. J. Microbiol. Методы 36, 181–192. DOI: 10.1016 / S0167-7012 (99) 00031-7
CrossRef Полный текст | Google Scholar
Идальго-Кантабрана, К., Альджери, Ф., Родригес-Ногалес, А., Вецца, Т., Мартинес-Камблор П., Марголлес А. и др. (2016). Влияние продуцирующего экзополисахарид цепочки Bifidobacterium animalis subsp. lactis перорально вводили на модели DSS-индуцированного колита на мышах. Фронт. Microbiol. 7: 868. DOI: 10.3389 / fmicb.2016.00868
CrossRef Полный текст | Google Scholar
Джиа, Дж., Франц, Н., Ху, К., Гибсон, Г. Р., Расталл, Р. А., и Маккартни, А. Л. (2010). Исследование фекальной микробиоты, связанной с хронической диареей собак. FEMS Microbiol. Ecol. 71, 304–312. DOI: 10.1111 / j.1574-6941.2009.00812.x
CrossRef Полный текст | Google Scholar
Келли Р. Л., Парк Дж. С., О’Махони Л., Минихим Д. и Фикс А. (2010). Безопасность и переносимость пищевых добавок с пробиотиком собачьего происхождения ( Bifidobacterium animalis, штамм AHC7), скармливаемым растущим собакам. Вет. Ther. 11, E1 – E14.
Google Scholar
Керр, К. Р., Белошапка, А. Н., и Суонсон, К.С. (2013а). Награды за достижения в ранней карьере 2011 и 2012 годов: использование геномной биологии для изучения микробиоты кишечника домашних животных. J. Anim. Sci. 91, 2504–2511. DOI: 10.2527 / jas.2012-6225
CrossRef Полный текст | Google Scholar
Керр, К. Р., Форстер, Г., Дауд, С. Е., Райан, Э. П., и Суонсон, К. С. (2013b). Влияние приготовленной с пищей темно-синей фасоли на фекальный микробиом здоровых собак-компаньонов. PLoS ONE 8: e74998. DOI: 10.1371 / journal.pone.0074998
CrossRef Полный текст | Google Scholar
Ламенделла, Р., Санто-Доминго, Дж. У., Келти, К., и Ортер, Д. Б. (2008). Бифидобактерии в кале и окружающей среде. Прил. Environ. Microbiol. 74, 575–584. DOI: 10.1128 / AEM.01221-07
CrossRef Полный текст | Google Scholar
Маккензи, Э., Риль, Дж., Банс, Х., Касс, П. Х., Нельсон, С., и Маркс, С. Л. (2010). Распространенность диареи и энтеропатогенов у ездовых собак. J. Vet. Междунар. Med. 24, 97–103. DOI: 10.1111 / j.1939-1676.2009.0418.x
CrossRef Полный текст | Google Scholar
Меконнен, З., Мека, С., Аяна, М., Богерс, Дж., Веркрюсс, Дж., И Левеке, Б. (2013). Сравнение индивидуальных и объединенных образцов стула для оценки интенсивности заражения гельминтами, передаваемыми через почву, и эффективности лекарств. PLoS Negl. Троп. Дис. 7: e2189. DOI: 10.1371 / journal.pntd.0002189
CrossRef Полный текст | Google Scholar
Milani, C., Hevia, A., Foroni, E., Duranti, S., Turroni, F., Lugli, G.A., et al. (2013). Оценка фекальной микробиоты: оптимизированный протокол анализа генов 16S рРНК с ионным потоком. PLoS ONE 8: e68739. DOI: 10.1371 / journal.pone.0068739
CrossRef Полный текст | Google Scholar
Milani, C., Lugli, G.A., Duranti, S., Turroni, F., Bottacini, F., Mangifesta, M., et al. (2014a). Геномная энциклопедия типовых штаммов рода Bifidobacterium . Прил. Environ. Microbiol. 80, 6290–6302. DOI: 10.1128 / AEM.02308-14
CrossRef Полный текст | Google Scholar
Милани, К., Лугли, Г. А., Туррони, Ф., Манкабелли, Л., Duranti, S., Viappiani, A., et al. (2014b). Оценка состава сообщества бифидобактерий в кишечнике человека с помощью протокола целевого секвенирования ампликонов (ITS). FEMS Microbiol. Ecol. 90, 493–503. DOI: 10.1111 / 1574-6941.12410
CrossRef Полный текст | Google Scholar
Milani, C., Mancabelli, L., Lugli, G.A., Duranti, S., Turroni, F., Ferrario, C., et al. (2015). Изучение вертикальной передачи бифидобактерий от матери к ребенку. Прил. Environ.Microbiol. 81, 7078–7087. DOI: 10.1128 / AEM.02037-15
CrossRef Полный текст | Google Scholar
Оджер-Гайлз, Дж., Мэтьюз, К., Виз, Дж. С., Прескотт, Дж. Ф., и Бурлин, П. (2006). Оценка катетер-ассоциированных инфекций мочевыводящих путей и мультирезистентных изолятов Escherichia coli из мочи собак с постоянными мочевыми катетерами. J. Am. Вет. Med. Доц. 229, 1584–1590. DOI: 10.2460 / javma.229.10.1584
CrossRef Полный текст | Google Scholar
Пабалан, Р.Т., и Бертетти, Ф. П. (2001). Катионообменные свойства природных цеолитов. Nat. Цеолиты 45, 453–518. DOI: 10.2138 / RMG.2001.45.14
CrossRef Полный текст | Google Scholar
Папайоанну Д., Кацулос П. Д., Панусис Н. и Карациас Х. (2005). Роль природных и синтетических цеолитов в качестве кормовых добавок в профилактике и / или лечении некоторых болезней сельскохозяйственных животных: обзор. Микропористый мезопористый материал. 84, 161–170. DOI: 10.1016 / j.микромезо.2005.05.030
CrossRef Полный текст | Google Scholar
Прасай, Т. П., Уолш, К. Б., Бхаттарай, С. П., Мидмор, Д. Дж., Ван, Т. Т., Мур, Р. Дж. И др. (2016). Кормление цыплят-несушек с добавлением биочара, бентонита и цеолита изменяет кишечную микробиоту и снижает нагрузку на кампилобактер. PLoS ONE 11: e0154061. DOI: 10.1371 / journal.pone.0154061
CrossRef Полный текст | Google Scholar
Quast, C., Pruesse, E., Yilmaz, P., Gerken, J., Schweer, T., Yarza, P., et al. (2013). Проект базы данных генов рибосомной РНК SILVA: улучшенная обработка данных и веб-инструменты. Nucleic Acids Res. 41, D590 – D596. DOI: 10.1093 / nar / gks1219
CrossRef Полный текст | Google Scholar
Родригес Фуэнтес, Г., Барриос, М. А., Ираисос, А., Пердомо, И., и Седре, Б. (1997). Энтерекс: противодиарейный препарат на основе очищенного природного клиноптилолита. Цеолиты 19, 441–448. DOI: 10.1016 / S0144-2449 (97) 00087-0
CrossRef Полный текст | Google Scholar
Рутгерс, Х.К., Батт, Р. М., Пруд, Ф. Дж., Соренсен, С. Х., Элвуд, К. М., Петри, Г. и др. (1996). Проницаемость и функция кишечника у собак с избыточным бактериальным ростом в тонком кишечнике. J. Small Anim. Практик. 37, 428–434. DOI: 10.1111 / j.1748-5827.1996.tb02443.x
CrossRef Полный текст | Google Scholar
Шлегель Б. Дж., Ван Дреймель Т., Славян Д. и Прескотт Дж. Ф. (2012). Clostridium perfringens типа А — острый геморрагический гастроэнтерит со смертельным исходом у собаки. банка.Вет. J. 53, 555–557.
Google Scholar
Симпсон, Дж. М., Мартино, Б., Джонс, У. Э., Баллам, Дж. М., и Маки, Р. И. (2002). Характеристика популяций фекальных бактерий у собак: влияние возраста, породы и пищевых волокон. Microb. Ecol. 44, 186–197. DOI: 10.1007 / s00248-002-0001-z
CrossRef Полный текст | Google Scholar
Сонг, С. Дж., Лаубер, К., Костелло, Э. К., Лозупоне, К. А., Хамфри, Г., Берг-Лайонс, Д. и др. (2013).Сожительствующие члены семьи разделяют микробиоту друг с другом и со своими собаками. Элиф 2, e00458. DOI: 10.7554 / eLife.00458
CrossRef Полный текст | Google Scholar
Стромпфова В., Поганы Симонова М., Ганчарчикова С., Мудронова Д., Фарбакова Дж., Мадьяри А. и др. (2014). Эффект от введения Bifidobacterium animalis B / 12 у здоровых собак. Анаэроб 28, 37–43. DOI: 10.1016 / j.anaerobe.2014.05.001
CrossRef Полный текст | Google Scholar
Suchodolski, J.С., Камачо Дж. И Штайнер Дж. М. (2008). Анализ бактериального разнообразия в двенадцатиперстной кишке, тощей кишке, подвздошной и толстой кишке собак с помощью сравнительного анализа гена 16S рРНК. FEMS Microbiol. Ecol. 66, 567–578. DOI: 10.1111 / j.1574-6941.2008.00521.x
CrossRef Полный текст | Google Scholar
Lactobacillus bifidus — обзор
1 Введение
Бифидобактерии — это высокоактивные, грамположительные, неспорообразующие, неподвижные и каталазонегативные анаэробные бактерии, принадлежащие к типу актинобактерий (Ishibashi et al., 1997). Они способны сбраживать глюкозу до молочной и уксусной кислот посредством метаболического пути, который характеризуется присутствием фермента фруктозо-6-фосфатфосфокетолазы (F6PPK) (Ballongue, 2004; Gomes and Malcata, 1999). Эти микроорганизмы были впервые выделены Tissier (1900), описаны как плеоморфные палочки различной формы, включая изогнутые, короткие и раздвоенные Y-образные формы, и первоначально классифицированы как Bacillus bifidus communis . Впоследствии они были переименованы в Lactobacillus bifidus до того, как Де Фрис и Стаутхамер (1967) предложили реклассифицировать их как отдельный род ( Bifidobacterium ) из-за присутствия F6PPK и одновременного отсутствия дегидрогеназы глюкозо-6-фосфатазы и альдолаза, i.е. два фермента, присутствующие в лактобациллах (Ballongue, 2004; Cheikhyoussef et al., 2008; Ishibashi et al., 1997).
Бифидобактерии — важная группа кишечных комменсальных бактерий человека, составляющая около 3–7% микробиоты у взрослых и, по некоторым данным, до 91% у новорожденных (Ballongue, 2004; Cheikhyoussef et al., 2009a) . Некоторые штаммы Bifidobacterium обладают свойствами, которые привели к их использованию в качестве пробиотиков. По данным Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО) и Всемирной организации здравоохранения (ВОЗ) (ФАО / ВОЗ, 2001), пробиотики — это живые микроорганизмы, которые при попадании в организм в достаточном количестве оказывают благоприятное воздействие на здоровье хозяина.Среди многих пробиотических свойств, которые приписывают бифидобактериям, являются: а) индукция выработки иммуноглобулинов, б) улучшение питательной ценности пищи за счет ассимиляции субстратов, не метаболизируемых хозяином, в) антиканцерогенная активность и г) синтез фолиевой кислоты ( Bevilacqua et al., 2003; Cheikhyoussef et al., 2009a; Collado et al., 2005a; Gomes and Malcata, 1999; Touré et al., 2003). Интересно, что для целей этого обзора известно, что некоторые бифидобактерии продуцируют противомикробные препараты (Cheikhyoussef et al., 2009b; Гибсон и Ван, 1994b; Гомес и Малката, 1999; Ibrahim and Salameh, 2001) и, более конкретно, бактериоцины (Anand et al., 1984, 1985; Cheikhyoussef et al., 2010; von Ah, 2006; Yildirim and Johnson, 1998; Yildirim et al., 1999).
Бактериоцины — это синтезированные рибосомами антимикробные пептиды, продуцируемые бактериями, которые активны против других бактерий, принадлежащих к одному и тому же виду (узкий спектр) или даже к разным родам (широкий спектр). Организмы-продуценты невосприимчивы к собственному бактериоцину (ам), это свойство опосредуется специфическими белками иммунитета (Cotter et al., 2005b). Продукция бактериоцина чаще всего имеет место во время поздней экспоненциальной или ранней стационарной фазы роста, часто под влиянием кворума и передачи сигналов стресса (Klaenhammer, 1988; Котельникова и Гельфанд, 2002; Riley and Chavan, 2007; Tagg et al., 1976). , и считается пробиотическим признаком (Dobson et al., 2012; O’Shea et al., 2012), способствующим подавлению кишечных патогенов. Кроме того, рост спроса на натуральные пищевые продукты, не содержащие химических консервантов, повысил интерес к их применению в качестве консервантов для обеспечения качества и безопасности пищевых продуктов.С момента открытия бактериоцинов (Cascales et al., 2007; Cotter et al., 2005a) были предприняты углубленные исследования для получения подробной информации об их физико-химических свойствах, механизмах действия и генетических детерминантах (Cotter et al., 2005a). ; Drider et al., 2006; Ennahar et al., 2000; Riley and Wertz, 2002; Tagg et al., 1976), все из которых имеют большое значение для продолжающихся попыток их более широкой коммерциализации. Значительная часть исследований бактериоцинов была сосредоточена на производстве и изучении пептидов из молочнокислых бактерий (LAB), таких как Lactococcus spp., Leuconostoc spp., Enterococcus spp. И Pediococcus spp., С целью их потенциального применения в качестве естественных консервантов пищевых продуктов (Cheikhyoussef et al., 2009a; Deegan et al., 2006; Riley and Chavan , 2007). Несмотря на способность бифидобактерий подавлять рост как грамотрицательных, так и грамположительных бактерий, их способность продуцировать бактериоцины до сих пор недооценивалась, поскольку их антимикробная активность часто приписывалась ингибирующему действию органических кислот и связанному с ним снижению pH ( Ballongue, 2004; Makras and De Vuyst, 2006; von Ah, 2006).

 Порошок, как правило, принимается от 2 недель до 3 месяцев. Для профилактики развития дисбактериоза по 5 доз 1-2 раза в сутки нужно принимать на протяжении 1-2 недель. Для детей, которые от рождения входят в группу риска с точки зрения развития дисбактериоза кишечника, внутрь нужно принимать по 1-2 дозы трижды ежесуточно. После полугода суточная доза увеличивается до 3 доз. Средство нужно давать детям сразу перед началом кормления. После годовалого возраста дети получают по 5 доз 2 или 3 раза в сутки. Если необходима профилактика дисбактериоза детям, болеющим пневмонией, сепсисом и др., в сутки следует принимать по 2-3 дозы средства. Если у ребенка отмечается нарушения функционирования ЖКТ, угроза проявления энтероколита, в сутки нужно принимать 10 доз.
Порошок, как правило, принимается от 2 недель до 3 месяцев. Для профилактики развития дисбактериоза по 5 доз 1-2 раза в сутки нужно принимать на протяжении 1-2 недель. Для детей, которые от рождения входят в группу риска с точки зрения развития дисбактериоза кишечника, внутрь нужно принимать по 1-2 дозы трижды ежесуточно. После полугода суточная доза увеличивается до 3 доз. Средство нужно давать детям сразу перед началом кормления. После годовалого возраста дети получают по 5 доз 2 или 3 раза в сутки. Если необходима профилактика дисбактериоза детям, болеющим пневмонией, сепсисом и др., в сутки следует принимать по 2-3 дозы средства. Если у ребенка отмечается нарушения функционирования ЖКТ, угроза проявления энтероколита, в сутки нужно принимать 10 доз. Далее средство перемешивается около 10 минут. Растворенный препарат хранить нельзя, оставшуюся нерастворенную часть можно хранить не более одного дня.
Далее средство перемешивается около 10 минут. Растворенный препарат хранить нельзя, оставшуюся нерастворенную часть можно хранить не более одного дня. При вагинальном применении на поверхность тампона, который пропитан водой или физиологическим раствором, наносится 3–5 мл концентрата. Такой тампон должен находиться во влагалище 4–8 часов.
При вагинальном применении на поверхность тампона, который пропитан водой или физиологическим раствором, наносится 3–5 мл концентрата. Такой тампон должен находиться во влагалище 4–8 часов.

 Не менее полезно будет назначение такого препарата малышам с анемией и диатезом, а также детям, переходящим на новое питание: к примеру, с грудного молока на детскую смесь.
Не менее полезно будет назначение такого препарата малышам с анемией и диатезом, а также детям, переходящим на новое питание: к примеру, с грудного молока на детскую смесь.